题目内容
13.乙酸是生活中常见的有机物之一,乙酸的官能团为羧基(写名称).用食醋浸泡有水垢(主要成分是CaCO3)的暖瓶或水壶,可以清除其中的水垢.写出该反应的化学方程式:2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑.写出蔗糖在稀酸作用下水解的方程式C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖).分析 羧酸的官能团为羧基;乙酸酸性比碳酸强,乙酸与碳酸钙反应生成乙酸钙与二氧化碳、水.蔗糖为二糖,水解生成葡萄糖和果糖,以此解答.
解答 解:羧酸的官能团为羧基,乙酸中含有羧基;乙酸具有酸的通性,且酸性比碳酸强,能与碳酸盐反应:2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑,蔗糖为二糖,水解生成葡萄糖和果糖,方程式为C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖).
故答案为:羧基; 2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑;C12H22O11+H2O$\stackrel{催化剂}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖).
点评 本题考查乙酸、蔗糖的性质,为高频考点,侧重于双基的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
9.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 16g 甲烷中含有的原子数为NA | |
| B. | 标准状况下,2.24 LCCl4含有的共价键数为0.4NA | |
| C. | 4.6 g乙醇中含有的C-H键的个数为0.6NA | |
| D. | 14 g乙烯和丙烯(它是乙烯的同系物,相对分子质量相差14)混合气体中的氢原子数为2NA |
10.下列有关物质在水溶液中的电离方程式书写正确的是( )
| A. | Na2CO3═2Na++CO32- | B. | AlCl3═Al3++3Cl- | ||
| C. | Mg(NO3)2═Mg+2+2NO3- | D. | KMnO4═K++Mn7++4O2- |
1.下列物质中,在一定条件下能水解的高分子化合物是( )
| A. | 肥皂 | B. | 油脂 | C. | 纤维素 | D. | 氨基酸 |
8.下列高分子化合物的认识不正确的是( )
| A. | 有机高分子化合物被称为聚合物或高聚物,是因为它们大部分是由小分子通过聚合反应而得到的 | |
| B. | 有机高分子化合物的相对分子质量很大,因而其结构很复杂 | |
| C. | 对于一块高分子材料来说,n是一个整数值,因而它的相对分子质量是确定的. | |
| D. | 材料可分为天然高分子材料和合成高分子材料两大类 |
5. 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
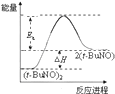
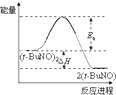
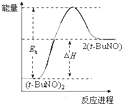
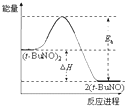
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
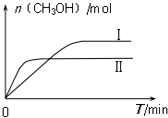
测得CH3OH的物质的量随时间的变化图:
①由如图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII
(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如表方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<c≤1.
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是ab.
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(2)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g).二甲醚与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CH3OCH3-12e-+16OH-═2CO32-+11H2O.根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
 研究CO、CO2的应用具有重要的意义.
研究CO、CO2的应用具有重要的意义.(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);
测得CH3OH的物质的量随时间的变化图:
①由如图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII
(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如表方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是ab.
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有3个C-H形成
(2)将燃煤废气中的CO转化为二甲醚的反应原理为:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g).二甲醚与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CH3OCH3-12e-+16OH-═2CO32-+11H2O.根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
3.羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与CO2相似,高温下分解为CO和S.下列有关说法正确的是( )
| A. | OCS中含有1个σ键和1个π键 | |
| B. | OCS高温分解时,碳元素化合价升高 | |
| C. | OCS、CO2、CO、S晶体类型相同 | |
| D. | 22.4 L OCS中约含有3×6.02×1023个原子 |
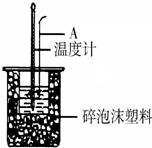 利用如图装置测定中和热的实验步骤如下
利用如图装置测定中和热的实验步骤如下