题目内容
 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1
(1)该反应的平衡常数K随温度的升高而
(2)上述反应达到平衡后,将体系中的C(s)全部移走,平衡
(3)下列事实能说明该反应在一定条件下已达到平衡状态的有
A.单位体积内每消耗1mol CO的同时生成1molH2
B.混合气体总物质的量保持不变
C.生成H2O(g)的速率与消耗CO的速率相等
D.H2O(g)、CO、H2的浓度相等
(4)上述反应在t0时刻达到平衡(如图),若在t1时刻改变某一条件,请在图中继续画出t1时刻之后c(CO)随时间的变化.
①缩小容器体积(用实线表示).
②降低温度(用虚线表示).
(5)某温度下,将6.0mol H2O(g)和足量的炭充入2L的密闭容器中,发生如下反应,C(s)+H2O(g)?CO(g)+H2(g),达到平衡时测得lgK=-1.0,求此温度下H2O(g)的转化率(计算结果保留3位有效数字,要求写出计算过程).
(6)己知:①C (s)+H2O(l)?CO(g)+H2(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③H2O(l)═H2 (g)+
| 1 |
| 2 |
则2C(s)+O2(g)═2CO2(g)的△H=
考点:化学平衡的影响因素,用盖斯定律进行有关反应热的计算,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)该反应正反应是吸热反应,升高温度平衡向正反应方向移动,据此判断;
(2)将C全部移走,由于是可逆反应,还会生成碳,生成的碳不能完全反应;
(3)依据平衡标志是正逆反应速率相同,各组分含量保持不变,结合反应特征和平衡移动原理分析选项;
(4)①缩小容器体积,压强增大,瞬间正反应速率加快,平衡向逆反应移动,正反应速率增大到新平衡;
②降低温度,瞬间正反应速率减慢,平衡逆反应移动,正反应速率增大到新平衡,据此作图;
(5)依据化学平衡三段式列式计算,转化率=
×100%计算得到;
(6)结合热化学方程式和盖斯定律计算所需热化学方程式得到反应焓变;
(2)将C全部移走,由于是可逆反应,还会生成碳,生成的碳不能完全反应;
(3)依据平衡标志是正逆反应速率相同,各组分含量保持不变,结合反应特征和平衡移动原理分析选项;
(4)①缩小容器体积,压强增大,瞬间正反应速率加快,平衡向逆反应移动,正反应速率增大到新平衡;
②降低温度,瞬间正反应速率减慢,平衡逆反应移动,正反应速率增大到新平衡,据此作图;
(5)依据化学平衡三段式列式计算,转化率=
| 消耗量 |
| 起始量 |
(6)结合热化学方程式和盖斯定律计算所需热化学方程式得到反应焓变;
解答:
解:(1)该反应正反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大;
故答案为:增大;
(2)将C全部移走,由于是可逆反应,还会生成碳,生成的碳不能完全反应,故平衡向左移动,
故答案为:向左移;
(3)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1 ,反应是气体体积增大的放热反应;分析选项正逆反应速率相同是平衡标志;
A.单位体积内每消耗1mol CO的同时生成1molH2 ,说明对一氧化碳或氢气正逆反应速率相同,故A正确;
B.反应前后气体物质的量变化,混合气体总物质的量保持不变说明反应达到平衡状态,故B正确;
C.生成H2O(g)的速率与消耗CO的速率相等只能说明反应逆向进行,不能说明反应达到平衡状态,故C错误;
D.H2O(g)、CO、H2的浓度相等和起始量变化量有关,不能作为平衡标志,故D错误;
故答案为:AB
(4)①缩小容器体积,压强增大,瞬间正反应速率加快,平衡向逆反应移动,正反应速率增大到新平衡;
②降低温度,瞬间正反应速率减慢,平衡逆反应移动,正反应速率增大到新平衡,故图象为:
故答案为: ;
;
(5)设H2O转化了xmol/L,依据化学平衡三段式列式计算;
C (s)+H2O(g)?CO (g)+H2 (g)
初始浓度(mol/L) 3.0 0 0
转化浓度(mol/L) x x x
平衡浓度(mol/L) 3.0-x x x
达到平衡时测得lgK=-1.0,K=0.1
K=
=
=0.1,解得x=0.5mol/L
所以α(H2O)=
×100%=16.7%;
答:α(H2O)=
×100%=16.7%;
(6)①C (s)+H2O(l)?CO(g)+H2(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③H2O(l)═H2 (g)+
O2(g)△H3
依据盖斯定律计算①×2+②-2×③得到,2C(s)+O2(g)═2CO2(g)△H=2△H1+△H2-2△H3;
故答案为:2△H1+△H2-2△H3;
故答案为:增大;
(2)将C全部移走,由于是可逆反应,还会生成碳,生成的碳不能完全反应,故平衡向左移动,
故答案为:向左移;
(3)C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ?mol-1 ,反应是气体体积增大的放热反应;分析选项正逆反应速率相同是平衡标志;
A.单位体积内每消耗1mol CO的同时生成1molH2 ,说明对一氧化碳或氢气正逆反应速率相同,故A正确;
B.反应前后气体物质的量变化,混合气体总物质的量保持不变说明反应达到平衡状态,故B正确;
C.生成H2O(g)的速率与消耗CO的速率相等只能说明反应逆向进行,不能说明反应达到平衡状态,故C错误;
D.H2O(g)、CO、H2的浓度相等和起始量变化量有关,不能作为平衡标志,故D错误;
故答案为:AB
(4)①缩小容器体积,压强增大,瞬间正反应速率加快,平衡向逆反应移动,正反应速率增大到新平衡;
②降低温度,瞬间正反应速率减慢,平衡逆反应移动,正反应速率增大到新平衡,故图象为:

故答案为:
 ;
;(5)设H2O转化了xmol/L,依据化学平衡三段式列式计算;
C (s)+H2O(g)?CO (g)+H2 (g)
初始浓度(mol/L) 3.0 0 0
转化浓度(mol/L) x x x
平衡浓度(mol/L) 3.0-x x x
达到平衡时测得lgK=-1.0,K=0.1
K=
| c(CO)c(H2) |
| c(H2O) |
| x2 |
| 3.0-x |
所以α(H2O)=
| 0.5mol/L |
| 3.0mol/L |
答:α(H2O)=
| 0.5mol/L |
| 3.0mol/L |
(6)①C (s)+H2O(l)?CO(g)+H2(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③H2O(l)═H2 (g)+
| 1 |
| 2 |
依据盖斯定律计算①×2+②-2×③得到,2C(s)+O2(g)═2CO2(g)△H=2△H1+△H2-2△H3;
故答案为:2△H1+△H2-2△H3;
点评:本题考查化学平衡常数及有关计算、化学平衡及反应速率的影响因素、热化学方程式书写等,难度中等,(2)是易错点,学生容易形成定式思维,认为碳是固体,不影响平衡移动,导致错误,注意审题是将碳完全移走.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
N2O5是一种新型绿色硝化剂,其性质和制备受到人们的关注.已知一定条件下会发生反应:2N2O5(g)?4NO2(g)+O2(g)△H>0,平衡常数为K.下列叙述正确的是( )
| A、上述反应的平衡常数随温度升高而增大 |
| B、上述反应达到平衡后,只增大氧气浓度,因为K值变大了,所以平衡将向左移动 |
C、N2O5与苯发生硝化反应除了生成硝基苯(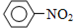 ),还有氧气生成 ),还有氧气生成 |
| D、以N2O4等为原料采用电化学方法可以合成N2O5,该合成应避免碱性环境 |

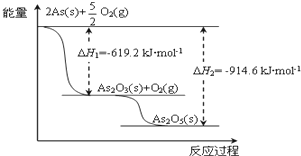 氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题:
氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界.试回答下列问题: I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.
I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.