题目内容
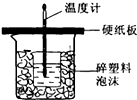 I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.
I.已知中和热是指酸跟碱发生中和反应生成lmol H2O时的反应热.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种仪器是
(2)大烧杯上如不盖硬纸板,则测得的温度计的读数变化值
(3)实验时所用盐酸及NaOH溶液的体积均为50mL,各溶液密度为1g/cm3,生成溶液的比热容C=4.0J/(g?℃),某次实验某学生所测实验数据如下.
| 实验起始温度(℃) | 实验中止温度(℃) | |
| 实验① | 25.00 | 28.64 |
| 实验② | 25.00 | 28.52 |
| 实验③ | 25.00 | 29.66 |
II.若在量热计中将100ml 0.50mol/L的CH3COOH溶液与100mL 0.50mol/LNaOH溶液混合,温度从298.16K升高到300.70K.已知量热计的热容常数(量热计各部件每升高1K所需的热量)是150.5J/K,0.250mol/LCH3COONa溶液比热容为4.03J/(g?K),溶液的密度为1.0g/mL
(4)试求CH3COOH的中和热(酸碱中和反应生成1mol水时所放出的热量)
(5)根据以上信息写出CH3COOH的电离热化学反应方程式
考点:中和热的测定,有关反应热的计算
专题:化学反应中的能量变化
分析:(1)根据量热计的构造来判断该装置的缺少仪器;中和热测定实验成败的关键是保温工作;
(2)不盖硬纸板,会有一部分热量散失;
(3)根据中和热计算公式Q=cm△T中涉及的未知数据进行判断;
(4)先根据溶液反应放出的热量Q=-cm△T+150.5J?0C-1×△T,再根据中和热△H=-
计算即可;
(5)CH3COOH是弱酸,电离过程需要吸收能量,根据盐酸和氢氧化钠反应以及乙酸与氢氧化钠反应的热量差计算;
(2)不盖硬纸板,会有一部分热量散失;
(3)根据中和热计算公式Q=cm△T中涉及的未知数据进行判断;
(4)先根据溶液反应放出的热量Q=-cm△T+150.5J?0C-1×△T,再根据中和热△H=-
| Q |
| n(H2O) |
(5)CH3COOH是弱酸,电离过程需要吸收能量,根据盐酸和氢氧化钠反应以及乙酸与氢氧化钠反应的热量差计算;
解答:
解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是 保温、隔热,减少实验过程中的热量损失;
故答案为:环形玻璃搅拌棒;防止热量损失;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(3)第1次实验盐酸和NaOH溶液起始平均温度为25℃,反应后温度为:28.64℃,反应前后温度差为:3.64℃;
第2次实验盐酸和NaOH溶液起始平均温度为25℃,反应后温度为:28.52℃,反应前后温度差为:3.52℃;
第3次实验盐酸和NaOH溶液起始平均温度为25℃,反应后温度为:29.66℃,反应前后温度差为:4.66℃;
第3组数据无效,温度差平均值=3.58℃;50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.0J/(g?℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.0J/(g?℃)×100g×3.58℃=1.432kJ,即生成0.025mol的水放出热量为:1.432kJ,所以生成1mol的水放出热量为1.432kJ×
=57.28kJ,即该实验测得的中和热△H=-57.28kJ/mol,
故答案为:△H=-57.28 kJ/mol;
(4)温度差△t=300.7K-298.16K=2.54K,Q=cm△t=2.54K×4.03J?(g?K)-1×200g+150.5J?K-1×2.54K=2429.51J,△H=-
=-
=-48.59kJ/mol,
故答案为:△H=-48.59kJ/mol;
(5)盐酸和氢氧化钠反应中和热△H=-57.28kJ/mol,乙酸与氢氧化钠反应△H=-48.59kJ/mol,CH3COOH是弱酸,电离过程需要吸收能量,CH3COOH的电离吸收的能量为:57.28-48.59=8.69KJ,所以CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H=+8.69 kJ/mol,
故答案为:CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H=+8.69 kJ/mol;
中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是 保温、隔热,减少实验过程中的热量损失;
故答案为:环形玻璃搅拌棒;防止热量损失;
(2)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(3)第1次实验盐酸和NaOH溶液起始平均温度为25℃,反应后温度为:28.64℃,反应前后温度差为:3.64℃;
第2次实验盐酸和NaOH溶液起始平均温度为25℃,反应后温度为:28.52℃,反应前后温度差为:3.52℃;
第3次实验盐酸和NaOH溶液起始平均温度为25℃,反应后温度为:29.66℃,反应前后温度差为:4.66℃;
第3组数据无效,温度差平均值=3.58℃;50mL的0.50mol/L盐酸与50mL的0.55mol/L氢氧化钠溶液的质量和为m=100mL×1g/cm3=100g,c=4.0J/(g?℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.0J/(g?℃)×100g×3.58℃=1.432kJ,即生成0.025mol的水放出热量为:1.432kJ,所以生成1mol的水放出热量为1.432kJ×
| 1mol |
| 0.025mol |
故答案为:△H=-57.28 kJ/mol;
(4)温度差△t=300.7K-298.16K=2.54K,Q=cm△t=2.54K×4.03J?(g?K)-1×200g+150.5J?K-1×2.54K=2429.51J,△H=-
| Q |
| n(H2O) |
| 2429.51J |
| 0.05mol |
故答案为:△H=-48.59kJ/mol;
(5)盐酸和氢氧化钠反应中和热△H=-57.28kJ/mol,乙酸与氢氧化钠反应△H=-48.59kJ/mol,CH3COOH是弱酸,电离过程需要吸收能量,CH3COOH的电离吸收的能量为:57.28-48.59=8.69KJ,所以CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H=+8.69 kJ/mol,
故答案为:CH3COOH(aq)?CH3COO-(aq)+H+(aq)△H=+8.69 kJ/mol;
点评:本题考查了中和热的测定方法、计算、误差分析,题目难度不大,注意掌握测定中和热的正确方法,明确实验操作过程中关键在于尽可能减少热量散失,使测定结果更加准确.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25℃时,下列说法中,不正确的是( )
| A、将体积均为100mL、浓度均为0.1mol/L的Ba(OH)2溶液与Na2SO4溶液混合,若混合后溶液的体积为100mL,则所得溶液的pH=13 |
| B、将等体积等浓度的醋酸与CH3COONa溶液混合,所得溶液中:c(Na+)+c(H+)═c(CH3COO-)+c(OH-) |
| C、将等体积等浓度的Na2CO3溶液与NaHCO3溶液混合,所得溶液中:2c(Na+)═c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、将等体积等浓度的Na2CO3溶液与NaOH溶液混合,所得溶液中:c(Na+)>c(OH-)>c(CO32-)>c(H+) |
下列各组固体物质中,在加水或加热的条件下,都能放出CO2的是( )
| A、NaHCO3和Al2(SO4)3 |
| B、NaHCO3和Na2CO3 |
| C、MgSO4和CaCO3 |
| D、Na2CO3和Al(NO3)3 |
 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得: 如图中各物质均由常见元素(原子序数≤20)组成.已知A、B、K为单质,且在常温下A和K为气体,B为固体.D为常见的无色液体.I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生.J是一种实验室常用的干燥剂.它们的相互转化关系如图所示(图中反应条件未列出).
如图中各物质均由常见元素(原子序数≤20)组成.已知A、B、K为单质,且在常温下A和K为气体,B为固体.D为常见的无色液体.I是一种常用的化肥,在其水溶液中滴加AgNO3溶液有不溶于稀HNO3的白色沉淀产生.J是一种实验室常用的干燥剂.它们的相互转化关系如图所示(图中反应条件未列出).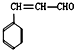 和化合物Ⅱ
和化合物Ⅱ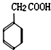 在一定条件下发生反应能生成化合物Ⅲ
在一定条件下发生反应能生成化合物Ⅲ ,请回答以下问题.
,请回答以下问题.