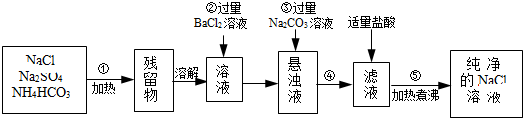
题目内容
13.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是 ( )| A. | NO2-和${NH}_{2}^{-}$ | B. | H3O+和ClO3- | C. | NO3-和CH3+ | D. | PO43-和SO42-. |
分析 离子中所有原子都在同一平面上,则离子的空间构型为直线形、V形或平面三角形,根据中心原子的价层电子对数判断分子的空间构型,价层电子对=σ 键电子对+中心原子上的孤电子对,据此分析.
解答 解:A、NO2-中心原子的价层电子对数=2+$\frac{1}{2}$(5+1-2×2)=3,含有一个孤电子对,空间构型为V形,NH4+中心原子的价层电子对数=4+$\frac{1}{2}$(5-1-4×1)=4,没有孤电子对,空间构型为正四面体,故A不选;
B、H3O+中心原子的价层电子对数=3+$\frac{1}{2}$(6-1-3×1)=4,含有一个孤电子对,空间构型为三角锥形,ClO3-中心原子的价层电子对数=3+$\frac{1}{2}$(7+1-3×2)=4,含有一个孤电子对,空间构型为三角锥形,故B不选;
C、NO3-中心原子的价层电子对数=3+$\frac{1}{2}$(5+1-3×2)=3,没有孤电子对,空间构型为平面三角形,CO32-中心原子的价层电子对数=3+$\frac{1}{2}$(4+2-2×3)=3,没有孤电子对,空间构型为平面三角形,故C选;
D、PO43-中心原子的价层电子对数=4+$\frac{1}{2}$(5+3-4×2)=4,没有孤电子对,空间构型为正四面体,SO42-中心原子的价层电子对数=4+$\frac{1}{2}$(6+2-4×2)=4,没有孤电子对,空间构型为正四面体,故D不选.
故选C.
点评 本题考查了离子的立体构型的判断,侧重考查杂化轨道理论的理解应用,把握常见分子或离子中原子的杂化及空间构型的判断方法为解答的关键,题目难度中等.

练习册系列答案
相关题目
3.下列有关化学用语错误的是( )
| A. | 乙醇分子球棍模型: | B. | 含有10个中子的氧原子${\;}_{-8}^{-18}$O | ||
| C. | -OH的电子式: | D. | CH4Si的结构式: |
4.关于下列图示的说法中错误的是( )


| A. | 用图①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图②所示实验装置排空气法收集CH4气体 | |
| C. | 图③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为放热反应 | |
| D. | 图④中的装置可形成原电池,电流从锌片经导线流向铜片 |
1.己知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2.有关该电池的说法正确的是( )
| A. | 放电过程是电能转化为化学能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时正极极附近溶液的pH变小 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
8.萘的结构简式为 ,其二硝基取代物有( )
,其二硝基取代物有( )
 ,其二硝基取代物有( )
,其二硝基取代物有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
18.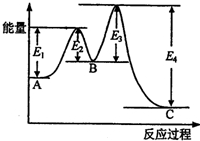 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
 某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )
某反应由两步反应A?B?C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能).下列有关叙述正确的是( )| A. | 两步反应均为吸热反应 | B. | 稳定性C>A>B | ||
| C. | A与C的能量差为E4 | D. | A?C反应,反应条件一定要加热 |
18.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3分别为1mol/L和0.5mol/L,取10ml此混合酸,向其中加入过量的铁粉,反应结束后产生的气体在标准状况下的体积是(HNO3被还原成NO)( )
| A. | 0.168L | B. | 0.112L | C. | 0.672L | D. | 0.224L |
19.下列物质中可以用来鉴别己烯、四氯化碳、苯的是( )
| A. | 水 | B. | 酸性高锰酸钾溶液 | ||
| C. | 液溴 | D. | NaOH溶液 |