题目内容
8.如图表示水溶液中c(H+)和c(OH-)的关系,下列判断正确的是( )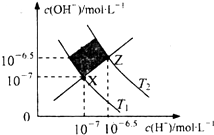
| A. | XZ线上任意点均表示溶液的pH=7 | |
| B. | 图中T1>T2 | |
| C. | M区域对应溶液中大量存在:Fe3+、Na+、C1-、SO42- | |
| D. | Z点对应的可能是CH3COOH和CH3COONa的混合液,且c(CH3COO-)=c(Na+) |
分析 A.XZ连线是一条Kw渐渐变大的线;
B.水的电离是吸热反应,升高温度促进水电离,则Kw逐渐增大;
C.在X、Z连线的上方,c(H+)<c(OH-),在X、Z连线的下方,c(H+)>c(OH-);
D.Z点溶液显中性.
解答 解:A、XZ连线是一条Kw渐渐变大的线,在X点,pH=7,在X点下方pH大于7,在X上方pH小于7,故A错误;
B、水的电离是吸热反应,升高温度促进水电离,则Kw逐渐增大,Z点Kw大于X点,所以T1<T2,故B错误;
C、XZ连线的斜率是1,存在c(H+)=c(OH-),在X、Z连线的上方M区域,c(H+)<c(OH-),在X、Z连线的下方,c(H+)>c(OH-),故M区域显碱性,铁离子不能共存,故C错误;
D、由于CH3COOH电离显酸性,而CH3COONa水解显碱性,故CH3COOH和CH3COONa的混合液可能显中性,即c(H+)=c(OH-),故c(CH3COO-)=c(Na+),故D正确.
故选D.
点评 本题考查了水的电离及影响因素,题目难度不大,注意明确影响水的电离的因素,明确溶液酸碱性取决于溶液中氢离子与氢氧根离子的浓度大小,不能以溶液的pH判断溶液酸碱性.

练习册系列答案
相关题目
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2L甲醛气体中电子数为8NA | |
| B. | 25℃时,pH=12的NaCN溶液中水电离的H+数为10-12NA | |
| C. | 1L0.5mol•L-1的CHCOOH溶液中所含的离子数和分子总数为0.5NA | |
| D. | 10mol•L-1100mL的浓硝酸与足量铜反应,硝酸得到的电子数为0.5NA |
19.下列根据实验现象得出的结论正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 废FeCl3蚀刻液X中加入少量铁粉,振荡 | 得到澄清溶液 | X中一定不含Cu2+ |
| B | 浓度均为0.1mol•L-1的Na2CO3和Na2S混合溶液中,滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S)大于 Ksp(Ag2CO3) |
| C | KNO3和KOH 混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | $N{{O}_{3}}^{-}$还原为NH3 |
| D | KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机相呈橙色 | 氧化性:Cl2>Br2 |
| A. | A | B. | B | C. | C | D. | D |
16.标准状况下,把4.48L CO2通过一定量的过氧化钠固体后收集到3.36L气体,则这3.36L气体的质量是( )
| A. | 4.8g | B. | 5.4g | C. | 6.0g | D. | 6.6g |
3.下列说法正确的是( )
| A. | 将SO2通入含HClO的溶液中生成H2SO4,说明HClO的酸性比H2SO4强 | |
| B. | 实验室做钠的实验时,余下的钠屑投入到废液缸中 | |
| C. | SiO2可以和NaOH溶液及HF溶液反应,SiO2属于两性氧化物 | |
| D. | 皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液 |
13.下列叙述正确的是( )
| A. | 饱和石灰水中加入少量CaO,恢复至原温度后,溶液的pH不变 | |
| B. | 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 | |
| C. | 盐酸中滴加氨水至中性,溶液中的溶质只有氯化铵 | |
| D. | 室温时pH=3的硫酸和pH=11的氨水等体积混合后,溶液的pH小于7 |
17.下列操作会促进H2O的电离,且使溶液呈碱性的是( )
| A. | 将纯水加热到95℃ | B. | 向水中加少量NaOH溶液 | ||
| C. | 向水中加少量Al2(SO4)3溶液 | D. | 向水中加少量CH3COONa溶液 |
18.下列电离方程式中,不正确的是( )
| A. | NaOH═Na++OHˉ | B. | H2SO4═H2++SO42- | ||
| C. | Na2CO3═2Na++CO32- | D. | CH3COOH?CH3COOˉ+H+ |
 (1)①如图甲表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是3.2mL.
(1)①如图甲表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是3.2mL.