题目内容
18.下列电离方程式中,不正确的是( )| A. | NaOH═Na++OHˉ | B. | H2SO4═H2++SO42- | ||
| C. | Na2CO3═2Na++CO32- | D. | CH3COOH?CH3COOˉ+H+ |
分析 用化学式和离子符号表示电离过程的式子,称为电离方程式.电离方程式中,离子所带电荷数一般可根据它们在化合物中的化合价来判断,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开.弱电解质的电离用“?”,强电解质的电离用“═”,以此来解答.
解答 解:A.NaOH是强电解质,完全电离,电离方程式为NaOH═Na++OH-,故A正确;
B.物质电离后角标要转化成化学计量数,硫酸是强电解质,完全电离生成氢离子、硫酸根离子,电离方程式为H2SO4═2H++SO42-,故B错误;
C.Na2CO3是强电解质,完全电离生成碳酸根离子、钠离子,电离方程式为Na2CO3═2Na++CO32-,故C正确;
D.乙酸是弱电解质,部分电离,用可逆符号,电离电离方程式为:CH3COOH?CH3COO-+H+,故D正确;
故选B.
点评 本题考查电离方程式的书写知识,注意强电解质在溶液中能完全电离,弱电解质部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不能拆开,B为强酸完全一步电离为该题易错点,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案
相关题目
8.如图表示水溶液中c(H+)和c(OH-)的关系,下列判断正确的是( )
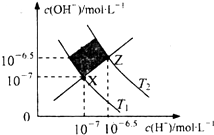

| A. | XZ线上任意点均表示溶液的pH=7 | |
| B. | 图中T1>T2 | |
| C. | M区域对应溶液中大量存在:Fe3+、Na+、C1-、SO42- | |
| D. | Z点对应的可能是CH3COOH和CH3COONa的混合液,且c(CH3COO-)=c(Na+) |
9.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,11.2L氧气所含的氧原子数为NA | |
| B. | 2.4g镁变成Mg2+时失去的电子数为0.2NA | |
| C. | 1mol•L-1的CaCl2溶液中含有的Cl-数为2NA | |
| D. | 标准状况下,2g氢气所含氢原子数为NA |
13.在反应Cl2+H2O?HCl+HClO中,氧化剂是( )
| A. | Cl2 | B. | H2O | C. | HCl | D. | HClO |
3.下列离子方程式正确的是( )
| A. | 硫酸铜溶液与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| B. | 漂白粉溶液在空气中发生的反应:Ca2++2ClO-+CO2+H2O═2HClO+CaCO3↓ | |
| C. | 碳酸钙溶解于盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 氯化铁溶液与碘化钾溶液反应:Fe3++2Iˉ═Fe2++I2 |
10.化学与生产、生活、社会密切相关.下列说法不正确的是 ( )
| A. | 面粉加工厂、铝制品抛光车间须严格控制粉尘浓度以防爆炸 | |
| B. | 甲醇燃料电池的能量转换效率远高于甲醇燃烧的能量转换效率 | |
| C. | 为了保证食品的安全与色香味统一,应全面禁止使用食品添加剂 | |
| D. | 石墨烯是一种由单层碳原子构成的新纳米材料,具有导电性 |
7.下列各组气体在光照和常温下均能共存的是( )
| A. | NO和O2 | B. | HCl和NH3 | C. | Cl2和CH4 | D. | SO2和CO2 |