题目内容
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,11.2L甲醛气体中电子数为8NA | |
| B. | 25℃时,pH=12的NaCN溶液中水电离的H+数为10-12NA | |
| C. | 1L0.5mol•L-1的CHCOOH溶液中所含的离子数和分子总数为0.5NA | |
| D. | 10mol•L-1100mL的浓硝酸与足量铜反应,硝酸得到的电子数为0.5NA |
分析 A、求出甲醛的物质的量,然后根据1mol甲醛中含16mol电子来分析;
B、溶液体积不明确;
C、CH3COOH溶液中不止有醋酸分子,还有水分子;
D、硝酸中被还原为NO2和物质的量和被还原为NO的物质的量不明确.
解答 解:A、标况下11.2L甲醛气体的物质的量为0.5mol,而1mol甲醛中含16mol电子,故0.5mol甲醛中含8mol电子即8NA个,故A正确;
B、溶液体积不明确,故溶液中水电离出的氢离子的个数无法计算,故B错误;
C、CH3COOH溶液中不止有醋酸分子,还有水分子,故溶液中含有的离子和分子总数大于0.5NA个,故C错误;
D、10mol/L100mL溶液中硝酸的物质的量为1mol,但1mol硝酸中被还原为NO2的硝酸的物质的量和被还原为NO的硝酸的物质的量不明确,故硝酸得到的电子数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.加热条件下把16.8g铁粉完全溶解于100mL某浓度的硝酸中,如反应只收集到0.4mol NO2和0.1mol NO,下列说法不正确的是( )
| A. | 反应后溶液中NO3-的物质的量为0.7 mol | |
| B. | 硝酸有剩余,铁粉反应完 | |
| C. | 反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1:2 | |
| D. | 该硝酸的浓度为12 mol•L-1 |
7.下列有关无机非金属材料的说法中,不正确的是( )
| A. | 高纯硅可用于制造半导体材料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | 玻璃、水泥、陶瓷、石英的成分中均含有硅酸盐 | |
| D. | Si3N4是一种新型无机非金属材料,可用于制造发动机 |
10.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$?_{甲}^{丁}$丙,下列有关物质的推断不正确的是( )
| A. | 若甲为Fe,则丁可能是Cl2 | B. | 若甲为焦炭,则丁可能是O2 | ||
| C. | 若甲为SO2,则丁可能是氨水 | D. | 若甲为NaOH 溶液,则丁可能是CO2 |
7.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4LCH4中含有氢原子数目为4NA | |
| B. | 1molNa2O2中含有的阴离子和阳离子的数目为2NA | |
| C. | 0.1mol/LCu(NO3)2溶液中含有的NO3-数目为0.2NA | |
| D. | 28gN2中所含的原子数目为NA |
8.如图表示水溶液中c(H+)和c(OH-)的关系,下列判断正确的是( )
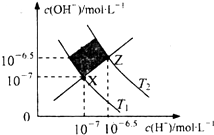

| A. | XZ线上任意点均表示溶液的pH=7 | |
| B. | 图中T1>T2 | |
| C. | M区域对应溶液中大量存在:Fe3+、Na+、C1-、SO42- | |
| D. | Z点对应的可能是CH3COOH和CH3COONa的混合液,且c(CH3COO-)=c(Na+) |
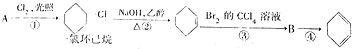
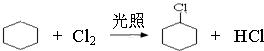 ,②的反应类型是消去反应.
,②的反应类型是消去反应. .
.