题目内容
17.下列操作会促进H2O的电离,且使溶液呈碱性的是( )| A. | 将纯水加热到95℃ | B. | 向水中加少量NaOH溶液 | ||
| C. | 向水中加少量Al2(SO4)3溶液 | D. | 向水中加少量CH3COONa溶液 |
分析 水的电离平衡:H2O?H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度,加入酸碱抑制电离,加入水解的盐促进电离;溶液显碱性,即c(H+)<c(OH-),据此分析.
解答 解:A、将纯水加热到95℃,水的电离得到促进,但纯水永远显中性,故A错误;
B、水中加少量NaOH溶液,水的电离被抑制,氢氧根离子大于氢离子浓度,溶液显碱性,故B错误;
C、向水中加少量硫酸铝溶液,铝离子水解结合氢氧根离子促进水的电离,溶液中氢离子浓度大于氢氧根离子,溶液显酸性,故C错误;
D、向水中加少量醋酸钠溶液,醋酸根离子水解促进水的电离,氢氧根离子大于氢离子浓度,溶液显碱性,故D正确;
故选D.
点评 本题考查了水的电离平衡影响因素的分析判断,酸碱抑制电离,水解的盐促进水的电离,题目较简单.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
7.设NA为阿伏加罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4LCH4中含有氢原子数目为4NA | |
| B. | 1molNa2O2中含有的阴离子和阳离子的数目为2NA | |
| C. | 0.1mol/LCu(NO3)2溶液中含有的NO3-数目为0.2NA | |
| D. | 28gN2中所含的原子数目为NA |
8.如图表示水溶液中c(H+)和c(OH-)的关系,下列判断正确的是( )
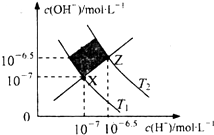

| A. | XZ线上任意点均表示溶液的pH=7 | |
| B. | 图中T1>T2 | |
| C. | M区域对应溶液中大量存在:Fe3+、Na+、C1-、SO42- | |
| D. | Z点对应的可能是CH3COOH和CH3COONa的混合液,且c(CH3COO-)=c(Na+) |
5.下列叙述I和II均正确并有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | 用酸度计测定SO2和CO2饱和溶液的pH,前者pH小 | 结论:说明H2SO3酸性强于H2CO3 |
| B | SiO2是酸性氧化物 | SiO2不与任何酸溶液反应 |
| C | 配制SnCl2溶液时,先将SnCl2溶于适量的稀盐酸中,再用蒸馏水稀释,保存时再在试剂瓶中加入少量的锡粒 | 抑制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| D | 浓硝酸具有强氧化性 | 应保存在棕色玻璃试剂瓶中 |
| A. | A | B. | B | C. | C | D. | D |
12.利用辉铜矿冶炼铜时发生的主要反应为Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2,该反应属于( )
| A. | 分解反应 | B. | 复分解反应 | C. | 置换反应 | D. | 化合反应 |
2.短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )
| X | Y | |||
| W | Z |
| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 原子半径大小:Y<W | |
| C. | X的非金属性大于Y | |
| D. | W的最高价氧化物的水化物具有两性 |
9.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,11.2L氧气所含的氧原子数为NA | |
| B. | 2.4g镁变成Mg2+时失去的电子数为0.2NA | |
| C. | 1mol•L-1的CaCl2溶液中含有的Cl-数为2NA | |
| D. | 标准状况下,2g氢气所含氢原子数为NA |
7.下列各组气体在光照和常温下均能共存的是( )
| A. | NO和O2 | B. | HCl和NH3 | C. | Cl2和CH4 | D. | SO2和CO2 |