题目内容
请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱,请写出电极反应式,负极 ,正极 ,并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路电子流向.
考点:设计原电池
专题:电化学专题
分析:Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,反应中Cu被氧化,为原电池的负极,则正极可为碳棒或不如Cu活泼的金属,电解质溶液为氯化铁溶液,正极发生还原反应,负极发生氧化反应,以此解答该题.
解答:
解:Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,正极可为碳棒,电解质溶液为氯化铁,
则原电池装置图可设计为 ,电子从铜极流向碳极,
,电子从铜极流向碳极,
故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+; .
.
则原电池装置图可设计为
 ,电子从铜极流向碳极,
,电子从铜极流向碳极,故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+;
 .
.
点评:本题综合考查原电池的设计及原电池的工作原理,为高考常见题型,侧重于学生的分析能力和计算能力的考查,有利于培养学生的良好的科学素养,难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列电离方程式正确的是( )
| A、H2SO3?2H++SO32- |
| B、HF=H++F- |
| C、NaHS=Na++H++S2- |
| D、H2CO3+H2O?H3O++HCO3- |
下列有关实验的做法或说法正确的是( )
| A、在制备乙烯的实验中,为了防止反应产生副产物,加热时应使温度迅速上升至170°C |
| B、分别向三支盛有乙酸乙酯的试管中加入氢氧化钠溶液、稀硫酸、水,并在水浴中加热,乙酸乙酯香味散失的速度按氢氧化钠、水、稀硫酸的顺序依次减慢 |
| C、将溴乙烷滴入NaOH溶液中,待充分反应再加入AgNO3溶液后有浅黄色沉淀生成 |
| D、向苯酚钠稀溶液中,通入少量二氧化碳气体,溶液中生成碳酸钠 |
关于Fe(OH)2 的制备能够成功的是( )
| A、向FeCl2 溶液中逐滴加入NaOH溶液 |
| B、向FeSO4溶液中逐滴加入氨水 |
| C、先将盛有NaOH溶液的长滴管插到FeSO4液面下,再挤出NaOH溶液可制得Fe(OH)2的白色沉淀 |
| D、取新配制的FeSO4溶液适量放入试管中,在加入一层植物油(密度小于水,且不溶于水),然后向试管内逐滴加入NaOH溶液 |
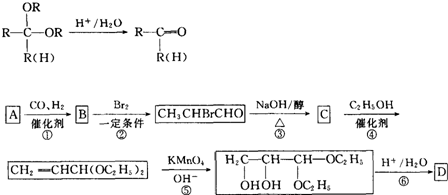
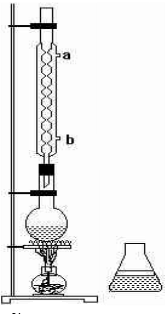
 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)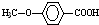 的同分异构体很多,其中符合下列条件有
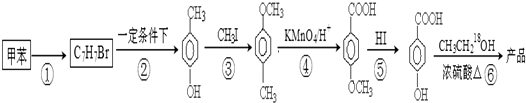
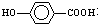
的同分异构体很多,其中符合下列条件有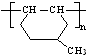 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)