题目内容
9.下列离子方程式正确的是( )| A. | NaHCO3溶液呈碱性的原因:HCO3-+H2O?CO32-+H3O+ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀质量最大:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| C. | 氢氧化铝溶于醋酸溶液:Al(OH)3+3H+═Al3++3H2O | |
| D. | 氯化铝溶液中加入过量氨水Al3++4OH-═AlO2-+2H2O |
分析 A.碳酸氢根离子水解生成碳酸和氢氧根离子;
B.向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀质量最大时生成硫酸钡和偏铝酸钾、水;
C.醋酸为弱酸应保留化学式;
D.不符合反应客观事实.
解答 解:A.NaHCO3溶液呈碱性的原因,离子方程式:HCO3-+H2O?H2CO3+OH-,故A错误;
B.向明矾溶液中逐滴加入Ba(OH)2溶液至沉淀质量最大时生成硫酸钡和偏铝酸钾、水,离子方程式::Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故B正确;
C.氢氧化铝溶于醋酸溶液,离子方程式:Al(OH)3+3CH3COOH═Al3++3H2O+3CH3COO-,故C错误;
D.氯化铝溶液中加入过量的氨水,氢氧化铝不溶于氨水,正确的离子方程式为:Al3++3NH3•H2O═3NH4++Al(OH)3↓,故D错误;
故选:B.
点评 本题离子方程式的书写,明确发生的反应是解答本题的关键,注意与量有关的离子反应即可解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列过程或现象与盐类水解无关的是( )
| A. | 可用碳酸钠与醋酸溶液制取少量二氧化碳 | |
| B. | 将NaHCO2与Al2(SO4)3两种溶液配制泡沫灭火剂 | |
| C. | 热的纯碱溶液的去污能力更强 | |
| D. | 实验室用饱和的FeCl3溶液制取氢氧化铁胶体 |
14.在分子式为CnH2n的烃分子中共用电子对的数目为( )
| A. | 3n | B. | 3n+1 | C. | 2n | D. | 2n+1 |
1.已知反应:2H2O(g)$?_{光照}^{Cu_{2}O}$2H2(g)+O2(g)△H=+484kJ•mol-1.某温度下,在4L密闭容器中加入纳米级Cu2O并通入0.2mol H2O(g),记录不同时间产生O2的物质的量如表:
下列说法正确的是( )
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0020 | 0.0032 | 0.0040 | 0.0040 |
| A. | 前20min的反应速率v(H2O)=2.5×10-5mol•L-1•min-1 | |
| B. | 达平衡时,至少需要从外界吸收的能量为0.968kJ | |
| C. | 增大c(H2O),可以提高水的分解率 | |
| D. | 使用纳米级Cu2O颗粒是为了提高催化效果 |
18.如图所示的电化学装置中,电极I为Al,其他电极均为Cu,则下列说法正确的是( )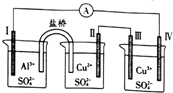

| A. | 电子流向:电极Ⅳ→(A)→电极I | |
| B. | 电极Ⅲ的电极反应:2H2O一4e一=4H++O2↑ | |
| C. | 电极Ⅱ的质量减少,电极Ⅲ的质量增加 | |
| D. | 三个烧杯中的SO42-浓度都始终保持不变 |
19.下列叙述正确的是( )
| A. | 0.5mol•L-1CuCl2溶液含有3.01×1023个Cu2+ | |
| B. | 28g聚乙烯分子含有的碳原子数为 NA | |
| C. | 0.2mol PCl5分子中,键数目为NA | |
| D. | 标准状况下,3.36L H2O含有9.03×1023个H2O分子 |

 物质A~D为CH3COOH、NaOH、HCl、NH3•H2O中的各一种,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如图所示.请回答下列问题:
物质A~D为CH3COOH、NaOH、HCl、NH3•H2O中的各一种,常温下将各物质的溶液从1mL稀释到1000mL,pH的变化关系如图所示.请回答下列问题:
 ,F
,F ;A含有的官能团名称是羟基;
;A含有的官能团名称是羟基;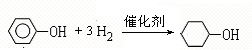 ;
; +2NaBr.
+2NaBr.