题目内容
8.下列化学用语的表达正确的是( )| A. | 原子核内有10个中子的氧原子:${\;}_{6}^{18}$O | |
| B. | 氯原子的结构示意图: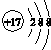 | |
| C. | Fe3+的最外层电子排布式为3s23p63d5 | |
| D. | 基态铜原子的外围电子排布图: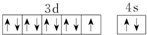 |
分析 A.氧原子中,质子数应该为8,而不是6,中子数为10,质量数为18;
B.氯原子核电荷数、核外电子数都是17;
C.Fe3+的离子结构示意图为 根据构造原理写出铁离子最外层电子排布式;
根据构造原理写出铁离子最外层电子排布式;
D.Cu是29号元素,其原子核外有29个电子,3d能级上有10个电子、4s能级上有1个电子,3d、4s能级上电子为其外围电子,根据构造原理书写其基态原子外围电子排布式,然后判断基态铜原子的外围电子排布图是否正确.
解答 解:A.该氧原子的质量数为18,正确表示应该为818O,故A错误;
B.氯原子核外电子总数为17,氯原子的结构示意图为 ,故B错误;
,故B错误;
C.铁离子最外层电子为13,根据构造原理可得:Fe3+的最外层电子排布式为3s23p63d5,故C正确;
D.Cu是29号元素,其原子核外有29个电子,3d能级上有10个电子、4s能级上有1个电子,3d、4s能级上电子为其外围电子,根据构造原理知其基态原子外围电子排布式为:3d104s1,图示中3d能级不是10个电子,故D错误;
故选C.
点评 本题考查了原子结构示意图、原子核外电子排布的判断,题目难度中等,注意掌握常见的化学用语的概念及表示方法,明确原子结构示意图与离子结构示意图的区别.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
5.下列离子方程式正确的是( )
| A. | 氯气与氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 碳酸钙加入盐酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| D. | 向MgCl2溶液加入氨水:Mg2++2OH-═Mg(OH)2↓ |
2.合成导电高分子化合物PPV的反应为:
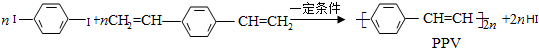
下列说法正确的是( )
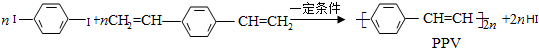
下列说法正确的是( )
| A. | PPV是聚苯乙炔 | |
| B. | 该反应为缩聚反应 | |
| C. | PPV与聚苯乙烯的最小结构单元组成相同 | |
| D. | 1 mol 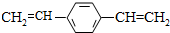 最多可与2 mol H2发生反应 最多可与2 mol H2发生反应 |
13.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 原子半径:Z>Y>X | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
17.下列物质不能导电但属于电解质的是( )
| A. | 熔融的氯化镁 | B. | 饱和食盐水 | C. | 固态二氧化碳 | D. | 液态氯化氢 |
18.下列物质的电离方程式正确的是( )
| A. | H2CO3?2H++CO32- | B. | HClO+H2O?H3O++ClO- | ||
| C. | NaHCO3?Na++HCO3- | D. | 在熔化时NaHSO4═Na++H++SO42- |
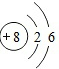 ;
; ;
; ,X属于共价化合物.
,X属于共价化合物. .
.