题目内容
13.同周期的X、Y、Z三种元素,已知它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 原子半径:Z>Y>X | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
分析 同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z.
A.同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
B.同周期自左而右原子半径逐渐减小;
C.非金属性越强,氢化物越稳定;
D.最低负化合价=最高正化合价-8.
解答 解:同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z.
A.同周期自左而右非金属性增强,故非金属性X>Y>Z,非金属性越强,最高价含氧酸的酸性越强,故含氧酸的酸性H3ZO4<H2YO4<HXO4,故A错误;
B.同周期自左而右原子半径逐渐减小,故原子半径:Z>Y>X,故B正确;
C.非金属性X>Y>Z,非金属性越强,氢化物越稳定,故氢化物稳定性按X、Y、Z顺序由强到弱,故C错误;
D.X、Y、Z最低负化合价分别为-1、-2、-3,负化合价的绝对值依次增大,故D错误,
故选B.
点评 本题考查性质与位置关系、元素周期律等,为高考常见题型,侧重对元素周期律的考查,注意理解掌握同周期元素性质递变规律,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,78g Na2O2的分子数为NA | |
| B. | 标准状况下,22.4L氯气在任何反应中转移电子数均为2NA | |
| C. | 标准状况下,22.4mL H2O中含水分子的个数约为1.24NA | |
| D. | 17g NH3溶于水后溶质NH3的个数为NA |
10.下列物质的除杂方案正确的是( )
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | Cl2 (g) | HCl(g) | 饱和NaCl溶液、浓硫酸 | 洗气 |
| B | Na2CO3(aq) | NaHCO3(aq) | 过量NaOH溶液 | 洗液 |
| C | 铁粉(s) | 铝粉(s) | 过量NaOH溶液 | 过滤 |
| D | FeCl3(aq) | AlCl3(aq) | 过量氨水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
1.下列说法错误的是( )
| A. | 各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7 | |
| B. | N原子的轨道表示式: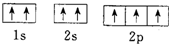 违反了泡利不相容原理 违反了泡利不相容原理 | |
| C. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 | |
| D. | 电子排布式(23V)1s22s22p63s23p63d34s2违反了洪特规则 |
8.下列化学用语的表达正确的是( )
| A. | 原子核内有10个中子的氧原子:${\;}_{6}^{18}$O | |
| B. | 氯原子的结构示意图: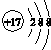 | |
| C. | Fe3+的最外层电子排布式为3s23p63d5 | |
| D. | 基态铜原子的外围电子排布图: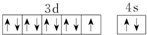 |
2.如图所示的有机物G,下列有关说法不正确的是( )
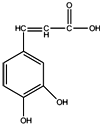

| A. | 1mol该有机物分别与足量的Na、NaOH、Na2CO3反应,消耗它们的物质的量之比为3:3:1 | |
| B. | 所有碳原子可能共平面 | |
| C. | 与溴水既能发生取代反应又能发生加成反应 | |
| D. | 能与新制的Cu(OH)2反应 |
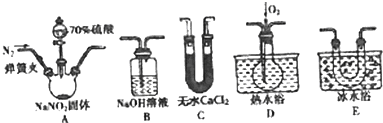
 已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):
已知下列反应(反应所需的其他条件和各物质的化学计量数均已略去):