题目内容
将27.4g Na2CO3和NaHCO3的混合物分成等量的两份,一份溶于水后加入足量某浓度的盐酸,收集到气体V L,消耗盐酸50mL.另一份直接加热至恒重,生成气体1.12L(所有气体体积均在标准状况下测定).试准确计算出:
(1)原混合固体中NaHCO3的物质的量:n(NaHCO3)= mol,
(2)V= L,盐酸的浓度c(HCl)= mol?L-1.
(1)原混合固体中NaHCO3的物质的量:n(NaHCO3)=
(2)V=
考点:有关混合物反应的计算
专题:
分析:(1)加热发生反应:2NaHCO3
Na2CO3+H2O+CO2↑,生成1.12L为二氧化碳,根据n=
计算二氧化碳物质的量,根据方程式计算每一份中碳酸氢钠的物质的量,原混合物中碳酸氢钠的物质的量为每一份中碳酸氢钠的2倍;
(2)根据(1)数据计算碳酸钠的物质的量,进而计算每一份中碳酸钠的物质的量,根据碳元素守恒计算二氧化碳的物质的量,再根据V=nVm计算二氧化碳体积,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒n(HCl)=n(NaCl),再根据c=
计算.
| ||
| V |
| Vm |
(2)根据(1)数据计算碳酸钠的物质的量,进而计算每一份中碳酸钠的物质的量,根据碳元素守恒计算二氧化碳的物质的量,再根据V=nVm计算二氧化碳体积,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3),根据氯离子守恒n(HCl)=n(NaCl),再根据c=
| n |
| V |
解答:
解:(1)加热生成二氧化碳的物质的量为
=0.05mol,由2NaHCO3
Na2CO3+H2O+CO2↑,可知每一份中碳酸氢钠的物质的量为0.05mol×2=0.1mol,故原混合物中碳酸氢钠的物质的量为0.1mol×2=0.2mol,故答案为:0.2;
(2)原混合物中碳酸钠的质量为27.4g-0.2mol×84g/mol=10.6g,其物质的量为
=0.1mol,每一份中碳酸钠为0.05mol,根据碳元素守恒,可知其中一份与盐酸反应生成二氧化碳的物质的量为0.1mol+0.05mol=0.15mol,二氧化碳体积为0.15mol×22.4L/mol=3.36L,即V=3.36;
根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.05mol×2+0.1mol=0.2mol,根据氯离子守恒n(HCl)=n(NaCl)=0.2mol,则c(HCl)=
=4mol/L,
故答案为:3.36;4.
| 1.12L |
| 22.4L/mol |
| ||
(2)原混合物中碳酸钠的质量为27.4g-0.2mol×84g/mol=10.6g,其物质的量为
| 10.6g |
| 106g/mol |
根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.05mol×2+0.1mol=0.2mol,根据氯离子守恒n(HCl)=n(NaCl)=0.2mol,则c(HCl)=
| 0.2mol |
| 0.05L |
故答案为:3.36;4.
点评:本题考查混合物计算,明确发生的反应是关键,注意利用守恒思想进行解答,侧重考查学生分析计算能力.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列途径制取:

已知NaClO4与NH4Cl投入的物质的量之比为1:1,相关物质的溶解度随温度变化如图所示,下列说法不正确的是( )
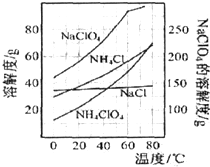

已知NaClO4与NH4Cl投入的物质的量之比为1:1,相关物质的溶解度随温度变化如图所示,下列说法不正确的是( )

| A、制得粗产品的反应原理为:NH4Cl+NaClO4=NaCl+NH4ClO4↓ |
| B、上述流程中操作Ⅰ为冷却结晶,操作Ⅱ为重结晶 |
| C、洗涤粗产品时,宜用冷水洗涤 |
| D、上述流程中蒸发浓缩时,蒸发至剩余少量溶液时,应停止加热,利用余热将其蒸干,防止晶体飞溅 |
下列各项叙述中,正确的是( )
| A、钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量 |
| B、价电子排布为4s24p3的元素位于第四周期第ⅢA族 |
| C、2p和3p轨道形状均为哑铃状,能量也相等 |
| D、在现代化学中,常利用原子光谱上的特征谱线来鉴定元素 |
配制一定物质的量浓度的NaOH溶液,下列叙述正确的是( )
| A、称量时,将NaOH固体直接放在托盘天平的左盘上 |
| B、将NaOH固体在烧杯中溶解后立即转移至容量瓶中 |
| C、定容时,俯视容量瓶的刻度线会使所配溶液的浓度偏高 |
| D、定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
铁及其合金在生产、生活中应用广泛,下列说法中正确的是( )
| A、生铁中含有碳,抗腐蚀能力比纯铁强 |
| B、铁与盐溶液所发生的反应都是置换反应 |
| C、铁与稀硫酸反应,铁与浓硫酸不能反应 |
| D、工业上可以用铝热反应的方法制取少量的铁 |
Na2CO3俗名纯碱,下列对Na2CO3采用不同分类法的分类.不正确的是( )
| A、Na2CO3是碱 |
| B、Na2CO3是盐 |
| C、Na2CO3是正盐 |
| D、Na2CO3是钠盐 |
下列热化学方程式书写正确的是( )
A、2SO2+O2
| |||
| B、C(s)+O2(g)═CO2(g)△H=+393.5 kJ/mol | |||
C、500℃、30MPa下,将0.5mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| D、2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体,放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2589.6kJ/moL |