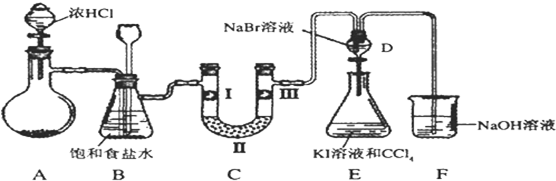
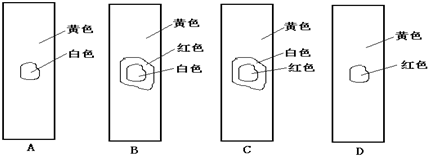
题目内容
下列滴定中,指示剂的选择或滴定终点颜色变化有错误的是( )
提示:2KMnO4+5K2SO3+3H2SO4=6K2SO4+2MnSO4+3H2O、I2+Na2S=2NaI+S↓
提示:2KMnO4+5K2SO3+3H2SO4=6K2SO4+2MnSO4+3H2O、I2+Na2S=2NaI+S↓
| 选项 | 滴定管中的溶液 | 锥形瓶中的溶液 | 指示剂 | 滴定终点颜色变化 |
| A | NaOH溶液 | CH3COOH溶液 | 酚酞 | 无色→浅红色 |
| B | HCl溶液 | 氨水 | 酚酞 | 浅红色→无色 |
| C | 酸性KMnO4溶液 | K2SO3溶液 | 无 | 无色→浅紫红色 |
| D | 碘水 | Na2S溶液 | 淀粉 | 无色→蓝色 |
| A、A | B、B | C、C | D、D |
考点:滴定实验中指示剂的使用
专题:化学实验基本操作
分析:A、酚酞在酸性溶液中无色;
B、酚酞在碱性溶液中呈浅红色;
C、酸性高锰酸钾为紫色;
D、碘遇淀粉变蓝色.
B、酚酞在碱性溶液中呈浅红色;
C、酸性高锰酸钾为紫色;
D、碘遇淀粉变蓝色.
解答:
解:A、锥形瓶中为酸,加入酚酞无色,达到滴定终点,溶液显碱性,溶液变为浅红色,故现象为:无色-浅红色,故A正确;
B、锥形瓶中为碱,达到滴定终点,溶液显酸性,应选择试剂甲基橙,现象是溶液由黄色变为红色,故B错误;
C、高锰酸钾为紫色,滴入高锰酸钾前溶液无色,滴入后变为紫色,到达滴定终点为浅紫色,故现象为:无色-浅紫色,故C正确;
D、碘遇淀粉变蓝色,加入碘前无色,滴加碘反应至终点,碘遇淀粉呈蓝色,故D正确,
故选B.
B、锥形瓶中为碱,达到滴定终点,溶液显酸性,应选择试剂甲基橙,现象是溶液由黄色变为红色,故B错误;
C、高锰酸钾为紫色,滴入高锰酸钾前溶液无色,滴入后变为紫色,到达滴定终点为浅紫色,故现象为:无色-浅紫色,故C正确;
D、碘遇淀粉变蓝色,加入碘前无色,滴加碘反应至终点,碘遇淀粉呈蓝色,故D正确,
故选B.
点评:本题主要考查的是常见指示剂以及其使用方法和实验现象的判断,综合性较强.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
化学与生产、生活密切相关,下列说法正确的是( )
| A、淀粉溶液、豆浆、雾、碳素墨水均可发生丁达尔现象 |
| B、合金、光导纤维、碳纤维、玻璃钢都属于复合材料 |
| C、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| D、光化学烟雾、臭氧空洞、温室效应、酸雨(硝酸型)的形成都与氮氧化物有关 |
 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强,或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,则对该反应叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强,或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,则对该反应叙述正确的是( )| A、正反应是放热反应,m+n>p+q |
| B、逆反应是放热反应,m+n>p+q |
| C、正反应是放热反应,m+n<p+q |
| D、逆反应是放热反应,m+n<p+q |
下列实验方法正确的是( )
| A、向无色溶液中加入氯化钡溶液有白色沉淀出现,再加入盐酸,沉淀不消失,则溶液中一定含有SO42- |
| B、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中可能含有K+ |
| C、用CCl4萃取碘水后分液时,先打开分液漏斗活塞,放出下层液体,再关闭活塞,更换烧杯后继续打开分液漏斗活塞,放出上层液体 |
| D、检验某溶液中是否含有Fe2+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变为红色,则说明溶液中一定含有Fe2+ |
下列对某些离子的检验及结论一定正确的是( )
| A、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42- |
| B、加入碳酸钠溶液有白色沉淀生成,再加盐酸,沉淀消失,则原溶液中一定有Ba2+ |
| C、通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I- |
| D、加入NaOH溶液并加热,产生使湿润蓝色石蕊试纸变红的气体,则原溶液一定有NH4+ |
下列说法正确的是( )
| A、化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
| B、凡是放热反应都是自发的,吸热反应都是非自发的 |
| C、若一个反应的平衡常数越大,则表示该反应速率也越大 |
| D、升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |
向100m 2mol?L-1的NaOH溶液中通入一定量的CO2气体,将溶液蒸发结晶,得到9.3g白色固体(假设不含结晶水),该白色固体的组成是( )
| A、只含Na2CO3 |
| B、只含NaHCO3 |
| C、NaOH和Na2CO3的混合物 |
| D、Na2CO3和NaHCO3的混合物 |