题目内容
8.下列叙述中正确的是( )| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
分析 A.中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量;
B.根据物质三态之间的转变也存在热量的变化;
C.热化学方程式中的化学计量数只表示物质的量,不表示微粒数,系数可以用分数表示;
D.反应物所具有的总能量小于生成物所具有的总能量,属于吸热反应;
解答 解:A.中和热是强酸与强碱的稀溶液发生中和反应生成1mol水时放出的热量,弱酸、弱碱溶液中存在电离平衡,电离过程是吸热过程,故A错误;
B.因物质三态之间的转变也存在热量的变化,而物质三态之间的转变是物理变化,所以能量变化不一定会引起化学变化,故B称为;
C.热化学方程式中的化学计量数只表示反应物或生成物的物质的量,不表示微粒数,系数可以用分数表示,故C正确;
D.反应物所具有的总能量小于生成物所具有的总能量,属于吸热反应;反应物所具有的总能量大于生成物所具有的总能量,属于放热反应,故D错误.
故选C.
点评 本题考查了化学反应中的能量变化、热化学方程式书写,侧重于放热反应和吸热反应的辨析、中和热的概念等,属于基础知识的考查,难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
19.下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题.
(1)地壳中含量最多的元素是O;
(2)N和O中,原子半径较小的是O;
(3)单质的化学性质最不活泼的是Ar;
(4)S原子结构示意图是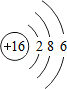 ;
;
(5)HF和HCl中,热稳定性较强的是HF;
(6)SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(7)元素最高价氧化物对应的水化物中,具有两性的是Al2O3(填化学式),碱性最强的是NaOH(填化学式);
(8)新制氯水有漂白作用,是因为其中含有HClO(填“HCl”或“HCIO”);
(9)碳元素的最高价氧化物的化学式是CO2,其碳元素与氧元素的物质的量比n(C):n(O)=1:2.
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Al | Si | S | Cl | Ar |
(2)N和O中,原子半径较小的是O;
(3)单质的化学性质最不活泼的是Ar;
(4)S原子结构示意图是
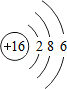 ;
;(5)HF和HCl中,热稳定性较强的是HF;
(6)SiO2常用于制造光导纤维(填一种高性能的现代通讯材料的名称);
(7)元素最高价氧化物对应的水化物中,具有两性的是Al2O3(填化学式),碱性最强的是NaOH(填化学式);
(8)新制氯水有漂白作用,是因为其中含有HClO(填“HCl”或“HCIO”);
(9)碳元素的最高价氧化物的化学式是CO2,其碳元素与氧元素的物质的量比n(C):n(O)=1:2.
3.下列分子属于手性分子的是( )
| A. | CCl2F2 | B. |  | C. | CH3CH2OH | D. |  |
18.化学反应经常伴随着颜色变化,下列有关反应获得的颜色不正确的是( )
| A. | 蛋白质遇浓硝酸呈现黄色 | |
| B. | 淀粉溶液遇单质碘呈现蓝色 | |
| C. | 苯酚显弱酸性,其溶液可以使石蕊试液变红色 | |
| D. | 苯酚在空气中氧化呈现粉红色 |

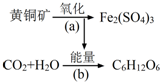 利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图: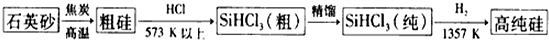
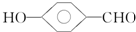 的沸点比
的沸点比 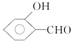 高,原因是
高,原因是 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.