题目内容
3.下列实验操作或对实验事实的描述正确的是( )| A. | 做银镜反应实验用的试管在实验前用热碱液洗涤 | |
| B. | 溴乙烷中少量的乙醇不能用水洗分液的方法除去 | |
| C. | 蒸馏石油时,冷凝管中的冷水应上进下出 | |
| D. | 准确取用20.00mL的溴的四氯化碳溶液的方法是:取一支25mL的碱式滴定管,先用溴的四氯化碳溶液润洗,再加溶液至1.00mL处,用手挤玻璃球,放溶液至21.00mL处 |
分析 A.热的碱性溶液能使油脂水解生成可溶性物质;
B.乙醇易溶于水,溴乙烷不溶于水;
C.蒸馏石油时,冷凝管中水采用逆流方式;
D.溴具有强氧化性,能腐蚀橡胶.
解答 解:A.油脂中含有酯基,在碱性条件下能发生水解反应生成可溶性盐和甘油,所以做银镜反应实验用的试管在实验前用热碱液洗涤,从而除去油脂,故A正确;
B.乙醇易溶于水,溴乙烷不溶于水,所以溴乙烷中少量的乙醇能用水洗分液的方法除去,故B错误;
C.蒸馏石油时,冷凝管中水采用逆流方式,目的是防止蒸气急剧冷却而炸裂冷凝管,故C错误;
D.溴具有强氧化性,能腐蚀橡胶,所以不能用碱式滴定管量取液溴,应该用酸式滴定管,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器洗涤、物质分离和提纯、仪器选取、实验安全等知识点,明确实验原理、仪器用途、实验基本操作等知识点是解本题关键,注意从物质性质、实验基本操作及实验安全方面分析解答,易错选项是D.

练习册系列答案
相关题目
11.根据下列合成路线判断反应类型正确的是( )
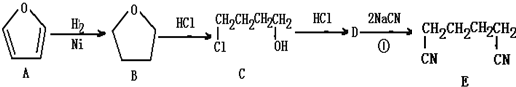
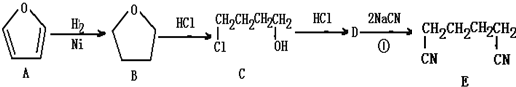
| A. | A→B的反应属于加成反应 | B. | B→C的反应属于酯化反应 | ||
| C. | C→D的反应属于消去反应 | D. | D→E的反应属于加成反应 |
18.化学反应经常伴随着颜色变化,下列有关反应获得的颜色不正确的是( )
| A. | 蛋白质遇浓硝酸呈现黄色 | |
| B. | 淀粉溶液遇单质碘呈现蓝色 | |
| C. | 苯酚显弱酸性,其溶液可以使石蕊试液变红色 | |
| D. | 苯酚在空气中氧化呈现粉红色 |
15.某烃完全燃烧生成CO2和H2O的物质的量相等,则此有机物的最简式可能是( )
| A. | CH | B. | CH2 | C. | CH3 | D. | CH2O |
12.下列关于反应速率的说法中,错误的是( )
| A. | 反应速率可衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 增大反应物浓度、提高反应物温度都能增大反应速率 | |
| D. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 |
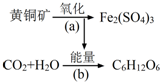 利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
利用某些细菌的特殊生物催化作用,可以使矿石中的金属在水溶液中溶解出来.例如氧化亚铁硫杆菌能利用空气中的氧气,在溶液中将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图: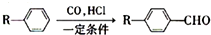 为合成某种液晶材料的中间体M,有人提出如下不同的合成途径
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径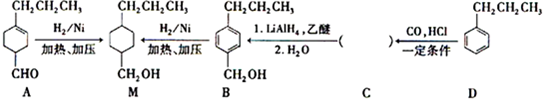
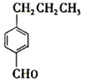 ,由C→B反应类型为加成反应.
,由C→B反应类型为加成反应.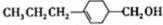 和
和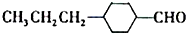 (写结构简式)两种互为同分异构体杂质生成.
(写结构简式)两种互为同分异构体杂质生成.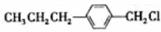 +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$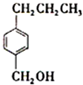 +NaCl;
+NaCl; .
.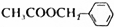 )是其中的一种,它可以从茉莉花香中提取,也可以用甲苯和乙醇为原料进行人工合成,一种合成路线如下:
)是其中的一种,它可以从茉莉花香中提取,也可以用甲苯和乙醇为原料进行人工合成,一种合成路线如下:
 .
. ,名称为苯甲醇.
,名称为苯甲醇.