题目内容
2.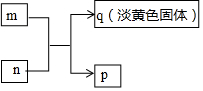 X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )
X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )| A. | 原子半径:Z>W>Y>X | |
| B. | 简单氢化物的稳定性:Y>W | |
| C. | m、n、p均为只含极性键的共价化合物 | |
| D. | Z、W形成的化合物可由两种盐溶液通过复分解反应制得 |
分析 p为常见的液态化合物,应为H2O,q是W的单质,且为淡黄色固体,应为S,Y、W同主族,则Y为O元素,X为H元素,W的最外层电子数为Z的2倍,则Z的最外层电子数为3,应为Al,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:由以上分析可知X为H、Y为O、Z为Al、W为S元素,m、n分别是H2S、SO2,p为H2O,q为S,
A.一般来说,原子核外电子层数越多,原子半径越大,同周期元素从左到右原子半径逐渐减小,则Z>W>Y>X,故A正确;
B.非金属性O>S,元素的非金属性越强,对应的氢化物越稳定,故A正确;
C.m、n分别是H2S、SO2,p为H2O,均为只含极性键的共价化合物,故C正确;
D.Z为Al、W为S元素,铝离子和硫离子发生互促水解反应,不能通过复分解反应生成,故D错误.
故选D.
点评 本题考查无机物的推断,为高频考点,涉及元素推断、元素周期律、元素化合物等知识点,侧重考查学生分析判断及知识运用能力,注意元素周期律中反常现象,题目难度不大.

练习册系列答案
相关题目
11.今年来,天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)利用钠碱循环法可脱除烟气中的SO2.
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
②吸收液吸收SO2的过程中,pH随m(SO32-):m(HSO3-)变化关系如下表:
由上表判断,NaHSO3溶液显酸性(填“酸、”“碱”或“中”),用化学平衡原理解释:HSO3-存在HSO3-?H++SO32- 和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
③当吸收液的pH将至约为6时,需送至电解槽再生,再生示意图如下:

写出HSO3-在阳极放电的电极反应式:HSO3-+H2O-2e-=SO42-+3H+,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
(2)用CH4催化还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O,△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O,△H=-1160kJ•mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为1.60NA(或1.6NA)(阿伏伽德罗常数的值用NA表示),放出的热量为173.4kJ.
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g):△H<0
一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K=2.67(计算结果保留两位小数).
(1)利用钠碱循环法可脱除烟气中的SO2.
①在钠碱循环法中,Na2SO3溶液可作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2=SO32-+H2O.
②吸收液吸收SO2的过程中,pH随m(SO32-):m(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
③当吸收液的pH将至约为6时,需送至电解槽再生,再生示意图如下:

写出HSO3-在阳极放电的电极反应式:HSO3-+H2O-2e-=SO42-+3H+,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
(2)用CH4催化还原NO2可以消除氮氧化的污染,例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O,△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O,△H=-1160kJ•mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为1.60NA(或1.6NA)(阿伏伽德罗常数的值用NA表示),放出的热量为173.4kJ.
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g):△H<0
一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K=2.67(计算结果保留两位小数).
10.下列叙述中,正确的是( )
| A. | 所有主族中都有非金属元素 | |
| B. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| C. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| D. | 元素周期表中从ⅢB到ⅡB 10个纵列的元素都是金属元素 |
17.下列关于物质结构和性质的叙述,正确的是( )
| A. | 用酸性KMnO4溶液可以检验绿矾(FeSO4•7H2O)是否变质 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在共价化合物分子内,可能存在离子键 | |
| D. | 在氮原子中,质子数为7而中子数不一定为7 |
7.化学与人类的生活、生产密切相关,下列说法中不正确的是( )
| A. | 油脂是单位质量产生能量最高的营养物质 | |
| B. | 石油裂解的目的是提高轻质液体燃料的产量 | |
| C. | 钠钾合金密度小,熔点低,所以可用作核反应堆的传热介质 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气和水蒸气可提取得到海水中的溴 |
14.对中国古代著作涉及化学的叙述,下列说法错误的是( )
| A. | 《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”指的是Ca(OH)2 | |
| B. | 《黄白第十六》中“曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐 | |
| C. | 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3 | |
| D. | 《汉书》中“高奴县有洧水可燃”,这里的“洧水”指的是石油 |
11.有机物甲的发光原理如下:

关于有机物甲和有机物乙的说法正确的是( )

关于有机物甲和有机物乙的说法正确的是( )
| A. | 互为同分异构体 | B. | 均可发生加成反应 | ||
| C. | 均可与碳酸氢钠溶液反应 | D. | 均最多有7个碳原子共平面 |
 ,D的简单气态氢化物的空间构型为三角锥形.
,D的简单气态氢化物的空间构型为三角锥形.