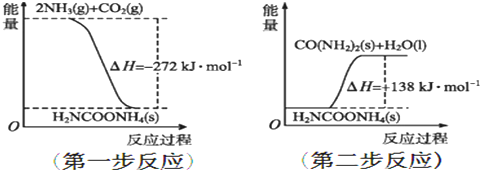
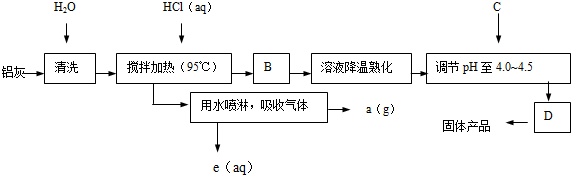
题目内容
6.将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液.则:①生成的H2在标准状况下的体积=2.24L;
②所得溶液中硫酸锌的物质的量浓度=1.25mol/L.
分析 根据n=$\frac{m}{M}$计算Zn的物质的量,再根据Zn+H2SO4=ZnSO4+H2↑计算生成氢气、硫酸锌的物质的量.
①根据V=nVm计算氢气体积;
②根据c=$\frac{n}{V}$计算所得溶液中硫酸锌的物质的量浓度.
解答 解:6.5g Zn的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol
设生成硫酸锌、氢气的物质的量分别为x、y,则:
Zn+H2SO4=ZnSO4+H2↑
1 1 1
0.1mol x y
所以x=y=$\frac{0.1mol×1}{1}$=0.1mol
(1)标况下生成氢气体积为:0.1mol×22.4L/mol=2.24L,
答:标况下生成氢气2.24L.
(2)所得溶液中硫酸锌的物质的量浓度为$\frac{0.1mol}{0.08L}$=1.25mol/L,
答:所得溶液中硫酸锌的物质的量浓度为1.25mol/L.
点评 本题考查化学方程式计算、物质的量有关计算,比较基础,有利于基础知识巩固.

练习册系列答案
相关题目
16.下列除杂方案合理的是( )
| A. | 除去苯中的少量苯酚:加浓溴水,过滤 | |
| B. | 除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,过滤 | |
| C. | 除去甲醛中少量的乙烯:通过盛有溴水的洗气瓶,洗气 | |
| D. | 除去溴苯中少量的Br2:加入稍过量氢氧化钠,分液 |
17.将a克Fe2O3、Al2O3样品溶解在过量的400mL 0.1mol•L-1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100mL,则NaOH 溶液的浓度为( )
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.4 mol•L-1 | D. | 0.8 mol•L-1 |
1.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 稀释浓硫酸时,应将浓硫酸沿器壁缓缓注入水中,并用玻璃棒不断搅拌 |
18.向某水溶液中加入铁粉后,溶液无明显变化,再滴加几滴溴水后,溶液立即变为血红色,下列结论错误的是( )
| A. | 原溶液中一定含有SCN- | B. | 原溶液中一定含有NO3- | ||
| C. | 原溶液可能呈酸性 | D. | Fe2+被Br2氧化成Fe3+ |
7.氯化亚铜常用作有机合成工业中的催化剂,为白色晶体,不溶于乙醇,微溶于水,易溶于浓盐酸形成络合离子[CuCl2]-.受潮露置空气中迅速氧化成碱式盐.实验室用下列流程制备:
注:①实验药品:硫酸铜晶体12.5g、氯化钠晶体6.0g、水200ml、铜粉3.5g、浓盐酸10ml.
②Na[CuCl2](易电离,溶液无色)$\frac{\underline{\;水\;}}{\;}$NaCl+CuCl↓ (白色沉淀).
请回答:
(1)写出实验室制取Na[CuCl2]的离子方程式Cu2++4Cl-+Cu=2[CuCl2]-.
(2)判断步骤②反应完全的现象是反应溶液由蓝色转变成无色透明时为止.
(3)步骤④有关抽滤操作,下列说法正确的是AD.
A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C.抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D.洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(4)步骤⑤用乙醇的水溶液洗涤的目的是水洗涤除去氯化亚铜表面吸附的杂质,提高产品纯度,同时减少产品的溶解,减少损失.
(5)步骤⑥烘干须在真空干燥箱中进行,其原因是氯化亚铜在潮湿的空气中能迅速氧化生成碱式盐而变质.
(6)氯化亚铜的定量分析:
①取样品0.25g和10ml过量的FeCl3溶液于250ml锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸锶铈标准溶液滴定.
已知:CuCl+FeCl3=CuCl2+FeCl2; Fe2++Ce4+=Fe3++Ce3+三次平行试验结果如下(平行试验结果相差不能超过1%):
则样品中CuCl的纯度为95.5%.(结果保留三位有效数字)

注:①实验药品:硫酸铜晶体12.5g、氯化钠晶体6.0g、水200ml、铜粉3.5g、浓盐酸10ml.
②Na[CuCl2](易电离,溶液无色)$\frac{\underline{\;水\;}}{\;}$NaCl+CuCl↓ (白色沉淀).
请回答:
(1)写出实验室制取Na[CuCl2]的离子方程式Cu2++4Cl-+Cu=2[CuCl2]-.
(2)判断步骤②反应完全的现象是反应溶液由蓝色转变成无色透明时为止.
(3)步骤④有关抽滤操作,下列说法正确的是AD.
A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C.抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D.洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(4)步骤⑤用乙醇的水溶液洗涤的目的是水洗涤除去氯化亚铜表面吸附的杂质,提高产品纯度,同时减少产品的溶解,减少损失.
(5)步骤⑥烘干须在真空干燥箱中进行,其原因是氯化亚铜在潮湿的空气中能迅速氧化生成碱式盐而变质.
(6)氯化亚铜的定量分析:
①取样品0.25g和10ml过量的FeCl3溶液于250ml锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸锶铈标准溶液滴定.
已知:CuCl+FeCl3=CuCl2+FeCl2; Fe2++Ce4+=Fe3++Ce3+三次平行试验结果如下(平行试验结果相差不能超过1%):
| 平行试验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(ml) | 24.35 | 24.05 | 23.95 |