题目内容
1.下列实验操作中错误的是( )| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 稀释浓硫酸时,应将浓硫酸沿器壁缓缓注入水中,并用玻璃棒不断搅拌 |
分析 A.分液时应避免液体重新混合而污染;
B.蒸馏时,温度计用于测量馏分的温度;
C.蒸发时应避免温度过高而导致固体迸溅;
D.稀释浓硫酸,应避免酸液飞溅.
解答 解:A.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,可防止液体重新混合而污染,故A正确;
B.蒸馏时,温度计用来测量馏分的温度,应靠近蒸馏烧瓶的支管口处,故B正确;
C.用蒸发方法使NaCl从溶液中析出时,应加热至蒸发皿中溶液析出大量固体时停止加热,用余热将固体蒸干,故C错误;
D.浓硫酸密度大于水,溶于水放出大量的热,稀释浓硫酸,应避免酸液飞溅,可将浓硫酸沿器壁缓缓注入水中,并用玻璃棒不断搅拌,故D正确.
故选C.
点评 本题考查常见物质的分离、提纯,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握相关实验方法、原理和注意事项,难度不大.

练习册系列答案
相关题目
11.下列鉴别方法不能达到实验目的是( )
| A. | 用激光笔鉴别淀粉溶液与氯化钠溶液 | |
| B. | 用KOH溶液鉴别NH4Cl、AlCl3、MgSO4、FeCl3四种溶液 | |
| C. | 用盐酸溶液鉴别Na2CO3溶液和Na2SiO3溶液 | |
| D. | 用BaCl2溶液鉴别AgNO3和Na2SO4 |
12.下列化学反应的离子方程式正确的是( )
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O | |
| C. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
9.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0 则金刚石比石墨的键能大 | |
| C. | 已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
16.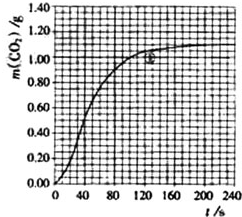 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验①中CO2质量随时间变化的关系如图:
实验①在70-90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)为由图可知70至90S,CO2生成的质量为m(CO2)=0.95g-0.84g=0.11g,物质的量为n(CO2)=0.0025mol,
由$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O可知消耗HNO3的物质的量为n(HNO3)=0.0025mol×2=0.005mol,
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=$\frac{△n}{V}$=$\frac{0.005mol}{0.025L}$=0.2mol•L-1,
反应时间为90s-70s=20s,所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=$\frac{△c}{△t}$=$\frac{0.2mol•{L}^{-1}}{20s}$=0.01mol•L-1•S-1,
答:70-90s范围内HNO3的平均反应速率为0.01mol•L-1•S-1..
 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探 究大理石规格(粗、细)对该反 应速率的影响;) |
| ② | ||||
| ③ | ||||
| ④ |
实验①在70-90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)为由图可知70至90S,CO2生成的质量为m(CO2)=0.95g-0.84g=0.11g,物质的量为n(CO2)=0.0025mol,
由$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O可知消耗HNO3的物质的量为n(HNO3)=0.0025mol×2=0.005mol,
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=$\frac{△n}{V}$=$\frac{0.005mol}{0.025L}$=0.2mol•L-1,
反应时间为90s-70s=20s,所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=$\frac{△c}{△t}$=$\frac{0.2mol•{L}^{-1}}{20s}$=0.01mol•L-1•S-1,
答:70-90s范围内HNO3的平均反应速率为0.01mol•L-1•S-1..
1.对水的电离平衡不产生影响的粒子是( )
| A. |  | B. | 26M3+ | C. |  | D. |  |