题目内容
18.向某水溶液中加入铁粉后,溶液无明显变化,再滴加几滴溴水后,溶液立即变为血红色,下列结论错误的是( )| A. | 原溶液中一定含有SCN- | B. | 原溶液中一定含有NO3- | ||
| C. | 原溶液可能呈酸性 | D. | Fe2+被Br2氧化成Fe3+ |
分析 Fe3+和SCN-反应生成络合物硫氰化铁而使溶液呈血红色,Fe2+和SCN-不反应,向某晶体的溶液中加入含Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现红色,说明原来溶液中含有SCN-,且Fe2+被溴氧化生成铁离子,以此解答该题.
解答 解:Fe3+和SCN-反应生成络合物硫氰化铁而使溶液呈血红色,Fe2+和SCN-不反应,向某晶体的溶液中加入含Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现红色,说明原来溶液中含有SCN-,且Fe2+被溴氧化生成铁离子,
A.只有铁离子遇SCN-才能形成红色的化合物,所以晶体中一定含有SCN-,故A正确;
B.不能说明是否含有NO3-,故B错误;
C.加入铁无现象,则说明不呈酸性,故C错误;
D.溴的氧化性大于铁离子,亚铁离子能被溴氧化为铁离子,故D正确.
故选BC.
点评 本题以亚铁盐和铁盐之间的转化为载体考查氧化还原反应,明确亚铁离子、铁离子的性质是解本题关键,知道亚铁离子、铁离子的检验方法及实验现象,题目难度不大.

练习册系列答案
相关题目
8.下列叙述中正确的是( )
| A. | 1 mol CO2的体积是22.4L | B. | 1 mol NaCl的质量是58.5 | ||
| C. | H2SO4的摩尔质量是98 g/mol | D. | 1 mol/L NaOH溶液中含有1 molNa+ |
9.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0 则金刚石比石墨的键能大 | |
| C. | 已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
3.15.6g Na2O2放入水中充分反应将产生的气体与铜和铁的混合物11.2g恰好完全反应,将所得氧化铜、氧化铁用足量CO还原,理论上最少需标准状况下CO的体积为( )
| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
1.对水的电离平衡不产生影响的粒子是( )
| A. |  | B. | 26M3+ | C. |  | D. |  |
19.分子式为C5H10O2,属于酯类的同分异构体有多少种( )
| A. | 9种 | B. | 13种 | C. | 10种 | D. | 11种 |
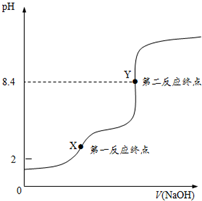 H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.
H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.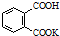 ,摩尔质量为204g•mol-1,易溶于水的固
,摩尔质量为204g•mol-1,易溶于水的固