题目内容
6.聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n•xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出.其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质.聚合氯化铝生产的工艺流程如图: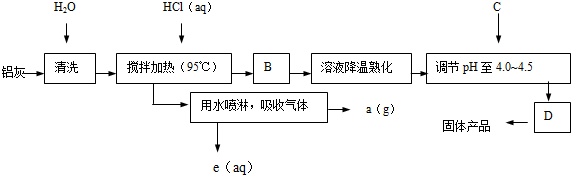
(1)搅拌加热操作过程中发生反应的离子方程式Al2O3+6H+=2Al3++3H2O;2Al+6H+=2Al3++3H2↑.
(2)生产过程中操作B和D的名称均为过滤(B和D为简单操作).
(3)反应中副产品a是H2(用化学式表示).
(4)生产过程中可循环使用的物质是HCl(用化学式表示).
(5)调节pH至4.0~4.5的目的是促进AlCl3水解,使晶体析出.
(6)实验室要测定水处理剂产品中n和x的值.为使测定结果更准确,需得到的晶体较纯净.生产过程中C物质可选用BD.
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2.
分析 铝灰主要含Al2O3、Al,另有SiO2等杂质,加水清洗后加入氯化氢溶液加热发生的反应是铝和盐酸反应生成氯化铝和氢气,氧化铝和盐酸反应生成氯化铝和水,水喷淋吸收气体得到气体A为氢气;过滤得到滤渣为二氧化硅,滤液为氯化铝,溶液降温熟化调节溶液PH得到通过促进其水解而结晶析出,
(1)铝灰主要含Al2O3、Al,还有SiO2等杂质,加入盐酸,氧化铝和铝能与盐酸反应,二氧化硅不能与盐酸反应.
(2)工艺流程为:铝灰与过量的盐酸反应,过滤后收集滤液,加热浓缩至饱和,调pH值,稍静置,过滤收集滤渣,最终的这个滤渣就是我们要的晶体.
(3)搅拌加热操作过程,加入盐酸,铝与盐酸反应,由氢气生成,加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),剩余气体为氢气.
(4)95°C加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),进行循环使用.
(5)溶液调pH值,促进铝离子水解,利用晶体析出.
(6)加入C目的是调节pH值,促进铝离子水解,但不能移入新杂质,其次在流程图中的B中或多或少会留有少量的HCl,因为加热不能保证所有的HCl全部挥发.
解答 解:(1)氧化铝与盐酸反应生成氯化铝和水,反应离子方程式为Al2O3+6H+=2Al3++3H2O;铝与盐酸反应生成氯化铝与氢气,反应离子方程式为2Al+6H+=2Al3++3H2↑.
故答案为:Al2O3+6H+=2Al3++3H2O;2Al+6H+=2Al3++3H2↑;
(2)铝灰与过量的盐酸反应,过滤后收集滤液,加热浓缩至饱和,调pH值,稍静置,过滤收集滤渣,最终的这个滤渣就是我们要的晶体,所以生产过程中操作B和D的均为过滤.
故答案为:过滤;
(3)搅拌加热操作过程,加入盐酸,铝与盐酸反应,有氢气生成,加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),剩余气体为氢气,反应中副产品a为H2.
故答案为:H2;
(4)95°C加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),可进行循环使用.
故答案为:HCl;
(5)铝离子水解,Al3++3H2O?Al(OH)3+3H+,降低氢离子浓度促进铝离子水解,有利于聚合氯化铝晶体析出.
故答案为:促进AlCl3水解,使晶体析出;
(6)用氢氧化钠和氨水调节pH值,会引入新的杂质,引入钠离子和铵根离子.所以可以加入Al和氧化铝进行处理,它二者是固体,多了可以过滤掉的,所以可以使得到的晶体较纯净.
故答案为:BD.
点评 以聚合氯化铝晶体的制备为载体,考查铝及其化合物性质、离子方程式、对工艺流程的理解、除杂等,难度中等,关键在于对工艺流程的理解和知识的迁移运用.

 纳米级二氧化锰的活性很高,以二氧化锰为电极构成的燃料电池如图所示.下列说法不正确的是 ( )
纳米级二氧化锰的活性很高,以二氧化锰为电极构成的燃料电池如图所示.下列说法不正确的是 ( )| A. | a极为正极,发生还原反应 | |
| B. | b极的电极反应式为(CH2O)n-4ne-+n H2O=nCO2+4n H+ | |
| C. | 电子由b极流出经用电器流向a极 | |
| D. | 放电时H+由质子交换膜左侧向右侧迁移 |
| A. | 1.12L | B. | 2.24L | C. | 3.36L | D. | 4.48L |
| A. |  | B. | 26M3+ | C. |  | D. |  |
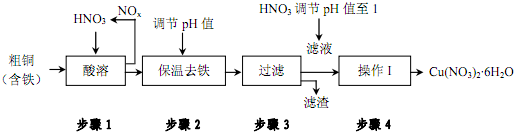
(1)步骤1中向装置内通入氧气可提高原料转化率、减少空气污染.用化学用语解释其原因氮氧化物和氧气、水反应生成硝酸,从而减少氮氧化物的排放,则降低空气污染
(2)步骤2中
①调节pH值为使Fe3+沉淀完全,可以向溶液中加入cd(填字母).
a.NaOH溶液 b.氨水 c.Cu(OH)2 d.CuO
②根据下表数据,溶液的 pH应保持在3.2≤pH值<4.7范围
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(4)在硝酸铜溶液中,各种离子浓度由大到小的顺序是c(NO3-)>c(Cu2+)>c(H+)>c(OH-).
(5)步骤4的操作I应该为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
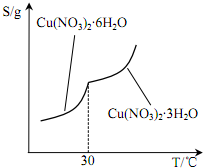
根据不同硝酸铜晶体的溶解度曲线(如图所示)该操作温度应控制在 25~30℃,原因为温度高于30℃时,Cu(NO3)2•6H2O水生成Cu(NO3)2•3H2O.
| A. | 500 mL 1 mol•L-1的KNO3溶液 | |
| B. | 500 mL 1 mol•L-1的Ba(NO3)2溶液 | |
| C. | 1000 mL 0.5 mol•L-1的Mg(NO3)2溶液 | |
| D. | 1000 mL 0.5 mol•L-1的Fe(NO3)3溶液 |
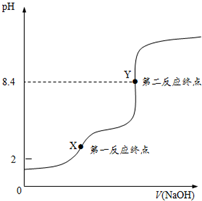 H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.
H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.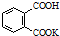 ,摩尔质量为204g•mol-1,易溶于水的固
,摩尔质量为204g•mol-1,易溶于水的固