题目内容
13. 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:(1)反应的△H大于0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为0.0010mol•L-1•s-1;反应的平衡常数K1为0.36mol/L.
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol•L-1•s-1的平均速率降低,经10s又达到平衡.
①T大于100℃(填“大于”或“小于”),判断理由是c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高.
②列式计算温度T时反应的平衡常数K2:1.28mol/L.
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向逆反应(填“正反应”或“逆反应”)方向移动,判断理由是增大压强平衡向气体体积减小即逆反应方向移动.
分析 (1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,据此判断;反应速率利用公式v=$\frac{△c}{△t}$计算得到;化学平衡常数利用化学平衡常数表达式计算;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
②计算T℃时两种物质的浓度,计算得到化学平衡常数;
(3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向.
解答 解:(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L-0.04mol/L=0.06mol/L,v(N2O4)=$\frac{0.06mol/L}{60s}$=0.0010mol•L-1•s-1;K1=$\frac{c{\;}^{2}(NO{\;}_{2})}{c(N{\;}_{2}{O}_{4})}$=$\frac{(0.12mol/L){\;}^{2}}{0.04mol/L}$=0.36mol/L,
故答案为:大于;0.0010;0.36mol/L;
(2)①N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:大于;c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高;
②平衡时,c(NO2)=0.120mol•L-1+0.0020mol•L-1•s-1×10s×2=0.16mol•L-1,c(N2O4)=0.040mol•L-1-0.0020mol•L-1•s-1×10s=0.020mol•L-1,K2=$\frac{(0.16mol/L){\;}^{2}}{0.020mol/L}$=1.28mol/L,故答案为:1.28mol/L;
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强平衡向气体体积减小即逆反应方向移动,故答案为:逆反应;增大压强平衡向气体体积减小即逆反应方向移动.
点评 本题考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,难度不大.


回答下列问题:
(1)反应I的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,氧化剂为SiO2(填化学式).
(2)经反应II所得的四氯化硅粗品中所含的物质如表:
| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.(3)反应III和IV中尾气的用途为制取盐酸;反应IV的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl.
(1)Z是Na2CO3(写化学式),X和Y反应的化学方程式为CO2+3H2=CH3OH+H2O.
(2)在120℃,如下容积固定的密闭容器中,当活塞被固定在整个装置的中间,X与Y按(1)在Ⅰ中进行反应:
| X(g)+Y(g)?CH3OH(g)+D(g) (未配平) | A(g)+B(g)?2C(g) |
①若 n=2.5,则1中起始时反应向正反应(填“正反应”或“逆反应”)方向进行.欲使起始时反应向该方向进行,则 n 的取值范围是1.5<n<4.5.
②若 n 分别取3.0和4.0,则在这两种情况下,当反应分别达到平衡时,A的物质的量不相等(填“相等”或“不相等”),理由是温度不同.
(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分体积分数如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O (g)═CO2(g)+H2 (g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=+247.3kJ•mol-1
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.
①在不同温度下催化剂的催化效率与乙酸的生成速率如图1所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.

②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(3)Li2O、Na2O、MgO均能吸收CO2.①如果寻找吸收CO2的其他物质,下列建议合理的是ab.
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2.原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是CO2+Li4SiO4$?_{700℃}^{500℃}$Li2CO3+Li2SiO3.
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品.
反应A:CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2
高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是CO2+2e-═CO+O2-.

| A. | 乙苯的同分异构体共有三种 | |
| B. | 可用Br2/CCl4鉴别乙苯和苯乙烯 | |
| C. | 乙苯和苯乙烯分子中均含有碳碳双健 | |
| D. | 乙苯和苯乙烯分子内共平面的碳原子数均为7 |
| A. | 单甘油酯、混甘油酯、苛性钾、氢硫酸、三氧化硫 | |
| B. | 胆矾、漂白粉、硫酸钠、次氯酸、氨气 | |
| C. | 明矾、水煤气、盐酸.醋酸、铜 | |
| D. | 冰醋酸、福尔马林、硫酸钡、氢硫酸、乙醇 |
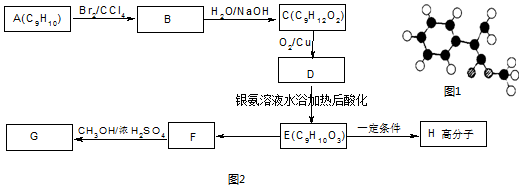
 ,G的一种同分异构体的结构简式为
,G的一种同分异构体的结构简式为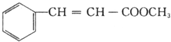 .
.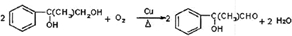
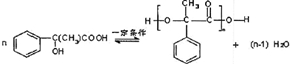 .
.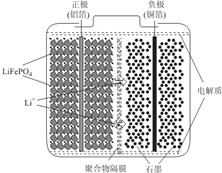 锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.
锂离子电池广泛应用于日常电子产品中,也是电动汽车动力电池的首选.正极材料的选择决定了锂离子电池的性能.磷酸铁钾(LiFePO4)以其高倍率性、高比能量、高循环特性、高安全性、低成本、环保等优点而逐渐成为“能源新星”.


