题目内容
在一定温度下,1mol金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的物质的3:1,求NO2的物质.
考点:化学方程式的有关计算
专题:计算题
分析:金属铜与足量某浓度的硝酸完全反应,HNO3中氮元素被还原为NO2和NO,根据电子转移守恒可知铜失去的电子转移给硝酸生成NO2和NO,所以反应过程中转移的电子为铜失去的电子,据此分析解答.
解答:
解:金属铜与足量某浓度的硝酸完全反应,HNO3中氮元素被还原为NO2和NO,设NO2为xmol,则NO为
mol,
n(Cu)=1mol,则反应过程中转移的电子为2mol,根据氧化还原反应电子转移守恒可知:铜失去的电子转移给硝酸生成NO2和NO,
NO2得到xmol电子,NO得到
mol×3=xmol电子,则x+x=2mol,所以x=1mol,即NO2的物质的量为1mol;
答:NO2的物质的量为1mol.
| x |
| 3 |
n(Cu)=1mol,则反应过程中转移的电子为2mol,根据氧化还原反应电子转移守恒可知:铜失去的电子转移给硝酸生成NO2和NO,
NO2得到xmol电子,NO得到
| x |
| 3 |
答:NO2的物质的量为1mol.
点评:本题考查氧化还原反应计算,难度不大,利用电子转移守恒与元素守恒计算是关键,注意守恒思想在氧化还原反应计算中的运用.

练习册系列答案
相关题目
下列实验能证明SO2存在的是( )
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使湿润的品红试纸褪色 ④通入足量的NaOH溶液,再加BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入氯水能使氯水褪色,再滴加BaCl2溶液有白色沉淀生成.
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使湿润的品红试纸褪色 ④通入足量的NaOH溶液,再加BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入氯水能使氯水褪色,再滴加BaCl2溶液有白色沉淀生成.
| A、都不能证明 |
| B、③④⑤能证明 |
| C、③⑤能证明 |
| D、只有⑤能证明 |
下列各化合物的命名中正确的是( )
A、 2,4-二硝基甲苯 2,4-二硝基甲苯 |
| B、(CH3CH2)2CHCH33-甲基戊烷 |
C、 1,3-二甲基-2-丁烯 1,3-二甲基-2-丁烯 |
D、 异戊烷 异戊烷 |
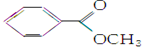 是一种重要的工业用有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.
是一种重要的工业用有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.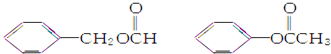


 +CH3CH2OH→
+CH3CH2OH→ +HCl,写出草酰氯(分子式C2O2Cl2,分子结构式:
+HCl,写出草酰氯(分子式C2O2Cl2,分子结构式: )与足量有机物D反应的最终化学方程式
)与足量有机物D反应的最终化学方程式 ,由邻甲基苯酚--中间产物--有机物A,请选择正确中间产物(填B或C)
,由邻甲基苯酚--中间产物--有机物A,请选择正确中间产物(填B或C) C:
C: