题目内容
下列实验能证明SO2存在的是( )
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使湿润的品红试纸褪色 ④通入足量的NaOH溶液,再加BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入氯水能使氯水褪色,再滴加BaCl2溶液有白色沉淀生成.
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使湿润的品红试纸褪色 ④通入足量的NaOH溶液,再加BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 ⑤通入氯水能使氯水褪色,再滴加BaCl2溶液有白色沉淀生成.
| A、都不能证明 |
| B、③④⑤能证明 |
| C、③⑤能证明 |
| D、只有⑤能证明 |
考点:二氧化硫的化学性质
专题:氧族元素
分析:一定有SO2存在,可利用二氧化硫的漂白性或还原性来证明,而不能利用酸性氧化物的性质来证明,以此来解答.
解答:
解:①能使澄清石灰水变浑浊,可能为二氧化碳,故不选;
②能使湿润的蓝色石蕊试纸变红色,可能为二氧化碳,故不选;
③能使品红溶液褪色,可能为氯气等,若加热后恢复红色为二氧化硫,故不选;
④通入足量的氢氧化钠溶液,再加BaCl2溶液有白色沉淀产生,该沉淀能溶于稀盐酸,沉淀可能为碳酸钡,气体可能为二氧化碳,故不选;
⑤通入氯水,氯水褪色,再加入BaCl2溶液有白色沉淀生成,白色沉淀为硫酸钡,则使氯水褪色的气体为二氧化硫,二氧化硫与氯水发生氧化还原反应,故选;
故选D.
②能使湿润的蓝色石蕊试纸变红色,可能为二氧化碳,故不选;
③能使品红溶液褪色,可能为氯气等,若加热后恢复红色为二氧化硫,故不选;
④通入足量的氢氧化钠溶液,再加BaCl2溶液有白色沉淀产生,该沉淀能溶于稀盐酸,沉淀可能为碳酸钡,气体可能为二氧化碳,故不选;
⑤通入氯水,氯水褪色,再加入BaCl2溶液有白色沉淀生成,白色沉淀为硫酸钡,则使氯水褪色的气体为二氧化硫,二氧化硫与氯水发生氧化还原反应,故选;
故选D.
点评:本题考查二氧化硫的性质及物质的鉴别,把握二氧化硫与二氧化碳的性质相似之处混合差异为解答的关键,③为解答的易错点,注意二氧化硫漂白为暂时性的,题目难度不大.

练习册系列答案
相关题目
下列离子在溶液中可大量共存,形成无色透明溶液的一组是( )
| A、K+、Na+、OH-、Cl- |
| B、Ba2+、Cu2+、NO3-、SO42- |
| C、Mg2+、Na+、OH-、SO42- |
| D、H+、Ba2+、NO3-、OH- |
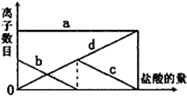 向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )
向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )| A、a:Cl-; b:K+; c:CO32-; d:HCO3- |
| B、a:K+; b:CO32-; c:Cl-; d:HCO3- |
| C、a:K+; b:CO32-; c:HCO3-; d:Cl- |
| D、a:K+; b:HCO3-;c:Cl-; d:CO32- |
下列有关物质的性质与应用不相对应的是( )
| A、SO2具有氧化性,可用于漂白纸浆 |
| B、明矾能水解生成Al (OH)3胶体,可用作净水剂 |
| C、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 |
| D、Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
某一反应物的浓度为1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
| A、0.04 |
| B、0.04mol/L |
| C、0.04mol/(L?S) |
| D、0.8mol/(L?S) |
下列反应的离子方程式,书写错误的是( )
| A、硫酸氢钠溶液与氢氧化钠溶液:H++OH-=H2O |
| B、新制氯水跟溴化钾溶液反应:Cl2+2Br-=2Cl-+Br2 |
| C、钠与水:2Na+2H2O=2Na++2OH-+H2↑ |
| D、碳酸钙跟稀盐酸反应:CO32-+2H+=H2O+CO2↑ |
 与
与 