题目内容
X、Y、Z是三种互不同族也不同周期的短周期元素,原子序数总和为26,它们可以结合成一种三原子化合物W,Z与同主族元素的短周期元素A可以组成化合物AZ2、AZ3.
(1)W的化学式是 .W与AZ2在溶液中发生反应的离子方程式是: .
(2)在一定条件下,AZ2和Z2发生如下反应:2AZ2(g)+Z2(g)?2AZ3(g)△H<0,该反应的化学平衡常数表达式K= ;降低温度,该反应K值 (填“增大”、“减小”或“不变”,以下同),二氧化硫转化率 ,化学反应速率 .
(1)W的化学式是
(2)在一定条件下,AZ2和Z2发生如下反应:2AZ2(g)+Z2(g)?2AZ3(g)△H<0,该反应的化学平衡常数表达式K=
考点:化学平衡建立的过程
专题:化学平衡专题
分析:X、Y、Z是三种互不同族也不同周期的短周期元素,Z与同主族元素的短周期元素A可以组成化合物AZ2、AZ3,判断为SO2,SO3,A为S,Z为O,X、Y、Z是三种互不同族也不同周期的短周期元素,判断一定含有H元素,原子序数总和为26,判断一定含有元素的原子序数=26-1-8=17,推断为Cl,则它们可以结合成一种三原子化合物W,为HClO;
(1)次氯酸具有强氧化性氧化二氧化硫为硫酸;
(2)二氧化硫和氧气催化氧化生成三氧化硫,结合平衡常数概念书写表达式;反应是放热反应,升温平衡逆向进行;
(1)次氯酸具有强氧化性氧化二氧化硫为硫酸;
(2)二氧化硫和氧气催化氧化生成三氧化硫,结合平衡常数概念书写表达式;反应是放热反应,升温平衡逆向进行;
解答:
解:X、Y、Z是三种互不同族也不同周期的短周期元素,Z与同主族元素的短周期元素A可以组成化合物AZ2、AZ3,判断为SO2,SO3,A为S,Z为O,X、Y、Z是三种互不同族也不同周期的短周期元素,判断一定含有H元素,原子序数总和为26,判断一定含有元素的原子序数=26-1-8=17,推断为Cl,则它们可以结合成一种三原子化合物W,为HClO;
(1)分析判断W为次氯酸,化学式为HClO,W与AZ2在溶液中发生反应的离子方程式是:HClO+SO2+H2O=3H++SO42-+Cl-;
故答案为:HClO,HClO+SO2+H2O=3H++SO42-+Cl-;
(2)在一定条件下,AZ2和Z2发生如下反应:2AZ2(g)+Z2(g)?2AZ3(g)△H<0,反应的化学方程式为:2SO2(g)+O2(g)=2SO3(g)△H<0,该反应的化学平衡常数表达式K=
;反应是放热反应,降温平衡正向进行,平衡常数增大,二氧化硫转化率增大,反应速率减小;
故答案为:
,增大,增大,减小;
(1)分析判断W为次氯酸,化学式为HClO,W与AZ2在溶液中发生反应的离子方程式是:HClO+SO2+H2O=3H++SO42-+Cl-;
故答案为:HClO,HClO+SO2+H2O=3H++SO42-+Cl-;
(2)在一定条件下,AZ2和Z2发生如下反应:2AZ2(g)+Z2(g)?2AZ3(g)△H<0,反应的化学方程式为:2SO2(g)+O2(g)=2SO3(g)△H<0,该反应的化学平衡常数表达式K=
| c2(SO3) |
| c2(SO2)c(O2) |
故答案为:
| c2(SO3) |
| c2(SO2)c(O2) |
点评:本题考查了物质性质和原子结构的分析推断,热化学方程式、离子方程式是、平衡常数书写方法,掌握基础是关键,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列反应,①符合图象描述特点,②对其进行分析,结论是正确的.则合理选项为( )
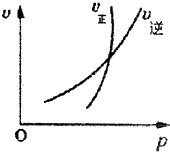

| A、2NO2(g)?N2O4(g);平衡后增大压强,气体颜色先变深后变浅 |
| B、N2(g)+3H2(g)?2NH3(g);将氨气液化分离后,有利于加快正反应速率 |
| C、4NH3(g)+5O2(g)?4NO(g)+6H2O(g);加大氧气浓度,能提高氨气平衡转化率 |
| D、2HI(g)?H2(g)+I2(g);平衡后又充入一定量HI,再次平衡时HI的转化率不变 |
 H2SO4、Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入的NaOH体积V之间的关系如图所示,则原混合溶液中Al3+、Mg2+和SO42-的物质的量之比为( )
H2SO4、Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入的NaOH体积V之间的关系如图所示,则原混合溶液中Al3+、Mg2+和SO42-的物质的量之比为( )| A、1:1:1 |
| B、5:3:2 |
| C、2:1:5 |
| D、3:2:2 |
可逆反应 H2 (g)+I2 (g)?2HI(g),温度一定,在1L的密闭容器中加入2molH2(g)和1molI2(g)开始反应,2min末测知容器中生成了1.2mol HI(g),下列说法正确的是( )
| A、H2(g)的消耗速率与I2(g)的生成速率始终相等 |
| B、反应过程中,H2(g)和I2(g)的转化率始终相等 |
| C、平衡前,正、逆反应速率的比值恒定 |
| D、反应开始至2min末,v(H2)=0.3mol?L-1?min-1 |
一定条件下,在2L的密闭容器中发生可逆反应:Fe(s)+CO(g)?Fe(s)+CO2(g),已知该反应的平衡常数(K)与温度(T)的关系如图甲,图乙是T1温度下该反应的c-t关系图象.则下列说法正确的是( )


| A、保持恒容恒温条件,向密闭容器中充入氦气,化学反应速率将变快 |
| B、若容器的容积不变,降低温度,c(CO2)/c(CO)减小 |
| C、保持恒容恒温(T1)条件,8min达化学平衡状态时,v(CO)=0.0625mol/(L?s) |
| D、保持恒容恒温(T1)条件,8min后再加入足量FeO粉末并充入1.5mol的CO气体,重新达到平衡时,CO的转化率为33.3% |
下列说法不正确的是( )
| A、可逆反应在一定条件下有一定的限度,当反应进行到一定限度后,反应物不再转化为生成物 |
| B、决定化学反应速率的主要因素是参加反应的物质的性质 |
| C、化学反应的速率和限度均可通过改变化学反应条件而改变 |
| D、化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
关于NaHCO3的性质,下列说法正确的是( )
| A、和酸反应放出等量的CO2所消耗的酸比Na2CO3多 |
| B、相同温度下溶解度比Na2CO3要大 |
| C、热稳定性比Na2CO3小 |
| D、NaHCO3只能和酸作用不能和碱作用 |