题目内容
一种新型火箭燃料TNAZ的结构如图所示.下列有关说法正确的是( )
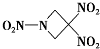
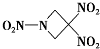
| A、分子中N、O间形成的共价键是非极性键 |
| B、分子中C原子的杂化轨道类型为sp3杂化 |
| C、第一电离能从大到小:O>N>C |
| D、该分子所有原子在同一平面上 |
考点:元素电离能、电负性的含义及应用,极性键和非极性键,原子轨道杂化方式及杂化类型判断
专题:
分析:A.不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键;
B.由价层电子对互斥理论确定原子杂化方式;
C.同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
D.具有甲烷类型的C原子、氨气分子类型的N原子时,分子中所有原子不能在同一平面上.
B.由价层电子对互斥理论确定原子杂化方式;
C.同一周期元素,元素的第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
D.具有甲烷类型的C原子、氨气分子类型的N原子时,分子中所有原子不能在同一平面上.
解答:
解:A.N、O元素电负性不同,其吸引电子能力不同,所以二者形成的化学键为极性键,故A错误;
B.该分子中C原子价层电子对个数都是4,所以所有C原子采用sp3杂化,故B正确;
C.C、N、O元素处于同一周期,且原子序数依次增大,但N元素处于第VA族,所以第一电离能顺序为N>O>C,故C错误;
D.该分子中每个N原子连接3个原子、每个C原子连接4个原子,为空间立体结构,所以所有原子不可能位于同一平面上,故D错误;
故选B.
B.该分子中C原子价层电子对个数都是4,所以所有C原子采用sp3杂化,故B正确;
C.C、N、O元素处于同一周期,且原子序数依次增大,但N元素处于第VA族,所以第一电离能顺序为N>O>C,故C错误;
D.该分子中每个N原子连接3个原子、每个C原子连接4个原子,为空间立体结构,所以所有原子不可能位于同一平面上,故D错误;
故选B.
点评:本题考查较综合,涉及电离能大小比较、原子杂化、微粒空间构型、化学键等知识点,明确元素周期律、价层电子对互斥理论、基本概念等知识点即可解答,注意规律中的异常现象,会利用知识迁移方法解答问题,题目难度不大.

练习册系列答案
相关题目
下列物质的水溶液能导电,但属于非电解质的是( )
| A、CH3COOH |
| B、Cl2 |
| C、NH4NO3 |
| D、SO2 |
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: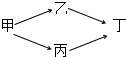 甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙.回答下列问题:
甲、乙、丙、丁四种烃的含氧衍生物,其分子中都含有一个或一个以上的官能团,通过下列转化关系可由甲制取丁:若丁的相对分子质量总为甲的两倍,乙的相对分子质量总大于丙.回答下列问题: