题目内容
下列物质的水溶液能导电,但属于非电解质的是( )
| A、CH3COOH |
| B、Cl2 |
| C、NH4NO3 |
| D、SO2 |
考点:电解质与非电解质,电解质溶液的导电性
专题:
分析:电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物.
解答:
解:A、CH3COOH在水中能电离,则其水溶液导电,即CH3COOH属于电解质,故A错误;
B、因非电解质是化合物,而Cl2是单质,即Cl2既不是电解质也不是非电解质,故B错误;
C、因NH4NO3在水溶液或熔化状态下都能导电,则NH4NO3属于电解质,故C错误;
D、SO2的水溶液能导电,是因二氧化硫和水反应生成亚硫酸,亚硫酸电离生成离子而导电,即发生电离不是SO2本身,故SO2属于非电解质,故D正确;
故选D.
B、因非电解质是化合物,而Cl2是单质,即Cl2既不是电解质也不是非电解质,故B错误;
C、因NH4NO3在水溶液或熔化状态下都能导电,则NH4NO3属于电解质,故C错误;
D、SO2的水溶液能导电,是因二氧化硫和水反应生成亚硫酸,亚硫酸电离生成离子而导电,即发生电离不是SO2本身,故SO2属于非电解质,故D正确;
故选D.
点评:本题考查电解质和非电解质,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.

练习册系列答案
相关题目
既能与盐酸反应,又能与氢氧化钠溶液反应的有机物是( )
| A、CH3COOH |
| B、H2N-CH2-COOH |
| C、CH3CH2OH |
| D、NaHCO3 |
下列说法正确的是( )
| A、中和热一定是强酸跟强碱反应放出的热量 |
| B、1 mol酸与1 mol碱完全反应放出的热量是中和热 |
| C、在稀溶液中,酸与碱发生中和反应生成1 mol H2O(L)时的反应热叫做中和热 |
| D、表示中和热的离子方程式为:H++OH-═H2O△H=-57.3 kJ/mol |
下列对0.2mo1/LNa2SO4溶液叙述不正确的是(NA表示阿伏加德罗常数的值)( )
| A、1L溶液中含0.4NA个Na+ |
| B、1L溶液中含Na+和SO42-总数为0.8NA |
| C、2L溶液中含有0.4NA个SO42- |
| D、2L溶液中Na+的物质的量浓度为0.4mol/L |
下面关于电解质的叙述中错误的是( )
| A、在水溶液中和熔融状态下均不导电的化合物叫非电解质 |
| B、电解质、非电解质都指化合物而言,单质不属于此范畴 |
| C、电解质在水中一定能导电,在水中导电的化合物一定是电解质 |
| D、酸、碱、盐、水是电解质,大部分有机物(酒精、蔗糖)、非金属氧化物是非电解质 |
下列关于催化剂的说法正确的是( )
| A、催化剂只能加快反应的速率 |
| B、催化剂在反应中是反应物 |
| C、催化剂有正催化剂和负催化剂之分 |
| D、催化剂能使不起反应的物质间发生反应 |
摩尔是( )
| A、国际单位制的一个基本物理量 |
| B、表示物质质量的单位 |
| C、表示6.02×1023个粒子的集合体 |
| D、计量微观粒子的物质的量的单位 |
下列物质中属于纯净物、化合物、盐、钙盐的是( )
| A、石灰水 |
| B、Ca(OH)2 |
| C、CaCO3 |
| D、NH3 |
一种新型火箭燃料TNAZ的结构如图所示.下列有关说法正确的是( )
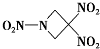
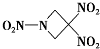
| A、分子中N、O间形成的共价键是非极性键 |
| B、分子中C原子的杂化轨道类型为sp3杂化 |
| C、第一电离能从大到小:O>N>C |
| D、该分子所有原子在同一平面上 |