题目内容
A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A B C D
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是 .
(3)用元素符号表示D所在周期第一电离能最大的元素是 ,电负性最大的元素是 .
(4)D的氢化物比C的氢化物的沸点 (填“高“或“低“),原因
(5)E元素在周期表中的位置 ,E的最高价离子的检验方法是 .
(6)画出D的核外电子排布图 ,这样排布遵循了 原理和 规则.
(7)用电子式表示D的氢化物的形成过程: .
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素在周期表中的位置
(6)画出D的核外电子排布图
(7)用电子式表示D的氢化物的形成过程:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,外围电子排布式为3s23p3,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,据此解答.
解答:
解:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,外围电子排布式为3s23p3,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素,
(1)由上述分析可知,A为Si,B为Na,C为P,D为N,故答案为:Si;Na;P;N;
(2)非金属越强最高价氧化物对应水化物酸性越强,非金属性N>P>Si,酸性最强的是HNO3,故答案为:HNO3;
(3)N在第二周期,同周期自左而右,第一电离能增大,所以第一电离能最大的元素是Ne,同周期自左而右,电负性增大,故电负性最大的元素是F,
故答案为:Ne;F;
(4)D的氢化物为NH3,氨气分子之间含有氢键,沸点比PH3高,故答案为:高;氨气分子之间含有氢键;
(5)E是Fe元素,铁元素位于第四周期第VIII族,检验Fe3+的方法为在溶液中滴加KSCN溶液,如果溶液呈血红色,则溶液中有存在Fe3+,
故答案为:第四周期第VIII族;在溶液中滴加KSCN溶液,如果溶液呈血红色,则溶液中有存在Fe3+;
(6)D为氮元素,原子核外电子排布式为1s22s22p3,核外电子排布图 ,符合泡利原理与洪特规则,
,符合泡利原理与洪特规则,
故答案为: ;泡利;洪特;
;泡利;洪特;
(7)用电子式表示NH3的形成过程为 ,故答案为:
,故答案为: .
.
(1)由上述分析可知,A为Si,B为Na,C为P,D为N,故答案为:Si;Na;P;N;
(2)非金属越强最高价氧化物对应水化物酸性越强,非金属性N>P>Si,酸性最强的是HNO3,故答案为:HNO3;
(3)N在第二周期,同周期自左而右,第一电离能增大,所以第一电离能最大的元素是Ne,同周期自左而右,电负性增大,故电负性最大的元素是F,
故答案为:Ne;F;
(4)D的氢化物为NH3,氨气分子之间含有氢键,沸点比PH3高,故答案为:高;氨气分子之间含有氢键;
(5)E是Fe元素,铁元素位于第四周期第VIII族,检验Fe3+的方法为在溶液中滴加KSCN溶液,如果溶液呈血红色,则溶液中有存在Fe3+,
故答案为:第四周期第VIII族;在溶液中滴加KSCN溶液,如果溶液呈血红色,则溶液中有存在Fe3+;
(6)D为氮元素,原子核外电子排布式为1s22s22p3,核外电子排布图
 ,符合泡利原理与洪特规则,
,符合泡利原理与洪特规则,故答案为:
 ;泡利;洪特;
;泡利;洪特;(7)用电子式表示NH3的形成过程为
 ,故答案为:
,故答案为: .
.
点评:本题考查结构性质位置关系应用,涉及元素周期律、核外电子排布规律、电子式等,难度不大,推断元素是解题的关键,注意熟练掌握元素周期律与物质性质的递变规律.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
下列说法正确的是( )
| A、中和热一定是强酸跟强碱反应放出的热量 |
| B、1 mol酸与1 mol碱完全反应放出的热量是中和热 |
| C、在稀溶液中,酸与碱发生中和反应生成1 mol H2O(L)时的反应热叫做中和热 |
| D、表示中和热的离子方程式为:H++OH-═H2O△H=-57.3 kJ/mol |
摩尔是( )
| A、国际单位制的一个基本物理量 |
| B、表示物质质量的单位 |
| C、表示6.02×1023个粒子的集合体 |
| D、计量微观粒子的物质的量的单位 |
下列物质中属于纯净物、化合物、盐、钙盐的是( )
| A、石灰水 |
| B、Ca(OH)2 |
| C、CaCO3 |
| D、NH3 |
下列叙述正确的是( )
| A、氯化钠溶液在电流作用下电离成钠离子和氯离子 |
| B、硫酸钡难溶于水,故硫酸钡不是电解质 |
| C、盐酸能导电,故盐酸是电解质 |
| D、SO3溶于水形成的溶液能导电,但SO3不是电解质 |
一种新型火箭燃料TNAZ的结构如图所示.下列有关说法正确的是( )
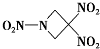
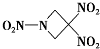
| A、分子中N、O间形成的共价键是非极性键 |
| B、分子中C原子的杂化轨道类型为sp3杂化 |
| C、第一电离能从大到小:O>N>C |
| D、该分子所有原子在同一平面上 |


 对硝基苯甲酸在医药、感光材料等工业中应用广泛.以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242℃,沸点约359℃,微溶于水,能升华.)的反应原理为:
对硝基苯甲酸在医药、感光材料等工业中应用广泛.以对硝基甲苯等为原料制取对硝基苯甲酸(黄色结晶,熔点242℃,沸点约359℃,微溶于水,能升华.)的反应原理为: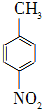 +Na2Cr2O7+4H2SO4→
+Na2Cr2O7+4H2SO4→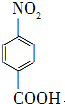 +Na2SO4+Cr2(SO4)3+5H2O
+Na2SO4+Cr2(SO4)3+5H2O