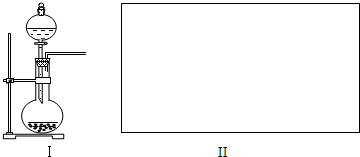
题目内容
室温,将100mL1mol/L的HCl与50mL 0.55mol/L的Ba(OH)2混合,则混合溶液的pH= .
考点:pH的简单计算
专题:
分析:先根据n=cV计算出氯化氢、氢氧化钡的物质的量,根据二者的物质的量及反应关系判断过量,然后计算出混合液中氢离子或氢氧根离子浓度,最后计算出溶液中氢离子浓度,最后根据pH=-lgc(H+)计算出溶液的pH.
解答:
解:100mL 1mol/L的HCl溶液中氢离子的物质的量为:n(H+)=n(HCl)=1mol/L×0.1L=0.1mol,
50mL 0.55mol/L的氢氧化钡溶液中氢氧根离子的物质的量为:n(OH-)=2n[Ba(OH)2]=0.55mol/L×2×0.05L=0.055mol,
两溶液混合后溶液显示酸性,混合液中氢离子浓度为:c(H+)=
=0.3,
则:pH=-lgc(H+)=-lg0.3=1-lg3,
故答案为:1-lg3.
50mL 0.55mol/L的氢氧化钡溶液中氢氧根离子的物质的量为:n(OH-)=2n[Ba(OH)2]=0.55mol/L×2×0.05L=0.055mol,
两溶液混合后溶液显示酸性,混合液中氢离子浓度为:c(H+)=
| 0.1mol-0.055mol |
| 0.1L+0.05L |
则:pH=-lgc(H+)=-lg0.3=1-lg3,
故答案为:1-lg3.
点评:本题考查了溶液pH的计算,题目难度不大,试题侧重基础知识的考查,注意掌握溶液pH的概念及计算方法,正确判断酸碱混合后溶液酸碱性为解答此类题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于催化剂的说法正确的是( )
| A、催化剂只能加快反应的速率 |
| B、催化剂在反应中是反应物 |
| C、催化剂有正催化剂和负催化剂之分 |
| D、催化剂能使不起反应的物质间发生反应 |
下列叙述正确的是( )
| A、氯化钠溶液在电流作用下电离成钠离子和氯离子 |
| B、硫酸钡难溶于水,故硫酸钡不是电解质 |
| C、盐酸能导电,故盐酸是电解质 |
| D、SO3溶于水形成的溶液能导电,但SO3不是电解质 |
一种新型火箭燃料TNAZ的结构如图所示.下列有关说法正确的是( )
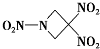
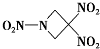
| A、分子中N、O间形成的共价键是非极性键 |
| B、分子中C原子的杂化轨道类型为sp3杂化 |
| C、第一电离能从大到小:O>N>C |
| D、该分子所有原子在同一平面上 |
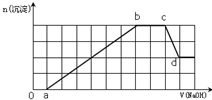 某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示,下列说法正确的是( )| A、d点溶液中含有的溶质有Na2SO4、NaAlO2、NH3?H2O |
| B、原溶液中含有的Fe3+、Mg2+和Al3+的物质的量之比为1:1:1 |
| C、ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-=Fe(OH)3↓ |
| D、原溶液中含有的阳离子必定有H+、NH4+、Al3+,但不能肯定Mg2+和Fe3+中的哪一种 |