题目内容
将23.2g磁性氧化铁溶于500ml 2mol/L的盐酸中,再加入8.4g的铁单质,计算:
(1)若溶液仍为500mL,分别计算氧化物与盐酸反应后的溶液中Fe2+、Fe3+、H+的物质的量浓度;
(2)产生氢气的体积(标况).
(1)若溶液仍为500mL,分别计算氧化物与盐酸反应后的溶液中Fe2+、Fe3+、H+的物质的量浓度;
(2)产生氢气的体积(标况).
考点:化学方程式的有关计算
专题:
分析:(1)发生反应:Fe3O4+8HCl=FeCl2+2FeCl3+4H2O,根据方程式计算参加反应HCl的物质的量,进而计算剩余HCl物质的量,计算生成FeCl2、FeCl3的物质的量,再根据c=
计算溶液中Fe2+、Fe3+、H+的物质的量浓度;
(2)加入铁粉,首先发生反应:2Fe3++Fe=3Fe2+,计算参加反应Fe物质的量,进而计算剩余的Fe,然后发生反应:Fe+2H+═Fe2++H2↑,根据方程式计算氢气的物质的量,进而计算氢气的体积.
| n |
| V |
(2)加入铁粉,首先发生反应:2Fe3++Fe=3Fe2+,计算参加反应Fe物质的量,进而计算剩余的Fe,然后发生反应:Fe+2H+═Fe2++H2↑,根据方程式计算氢气的物质的量,进而计算氢气的体积.
解答:
解:(1)23.2g磁性氧化铁的物质的量为
=0.1mol,n(HCl)=0.5L×2mol/L=1mol,
Fe3O4+8 HCl=FeCl2+2 FeCl3+4H2O
0.1mol 0.8mol 0.1mol 0.2mol
故剩余HCl为1mol-0.8mol=0.2mol
则反应后溶液中:c(Fe2+)=
=0.2mol/L
c(Fe3+)=
=0.4mol/L
c(H+)=
=0.4mol/L
答:溶液中Fe2+为0.2mol/L,Fe3+为0.4mol/L,H+的物质的量浓度为0.4mol/L.
(2)8.4gFe的物质的量为
=0.15mol,
2 Fe3++Fe=3Fe2+,
0.2mol 0.1mol
故剩余Fe物质的量为0.15mol-0.1mol=0.05mol,
由Fe+2 H+═Fe2++H2↑,可知0.05molFe完全反应消耗氢离子为0.05mol×2=0.1mol<0.2mol,故氢离子有剩余,由方程式可知生成氢气为0.05mol,标况下氢气的体积为0.05mol×22.4L/mol=1.12L,
答:生成氢气的体积为1.12L.
| 23.2g |
| 232g/mol |
Fe3O4+8 HCl=FeCl2+2 FeCl3+4H2O
0.1mol 0.8mol 0.1mol 0.2mol
故剩余HCl为1mol-0.8mol=0.2mol
则反应后溶液中:c(Fe2+)=
| 0.1mol |
| 0.5L |
c(Fe3+)=
| 0.2mol |
| 0.5L |
c(H+)=
| 0.2mol |
| 0.5L |
答:溶液中Fe2+为0.2mol/L,Fe3+为0.4mol/L,H+的物质的量浓度为0.4mol/L.
(2)8.4gFe的物质的量为
| 8.4g |
| 56g/mol |
2 Fe3++Fe=3Fe2+,
0.2mol 0.1mol
故剩余Fe物质的量为0.15mol-0.1mol=0.05mol,
由Fe+2 H+═Fe2++H2↑,可知0.05molFe完全反应消耗氢离子为0.05mol×2=0.1mol<0.2mol,故氢离子有剩余,由方程式可知生成氢气为0.05mol,标况下氢气的体积为0.05mol×22.4L/mol=1.12L,
答:生成氢气的体积为1.12L.
点评:本题考查化学方程式计算、混合物计算,明确发生的反应是关键,反应中氯离子不变,可以利用电荷守恒计算氢离子浓度,可以利用电子转移守恒计算生成氢气.

练习册系列答案
相关题目
下面关于电解质的叙述中错误的是( )
| A、在水溶液中和熔融状态下均不导电的化合物叫非电解质 |
| B、电解质、非电解质都指化合物而言,单质不属于此范畴 |
| C、电解质在水中一定能导电,在水中导电的化合物一定是电解质 |
| D、酸、碱、盐、水是电解质,大部分有机物(酒精、蔗糖)、非金属氧化物是非电解质 |
一种新型火箭燃料TNAZ的结构如图所示.下列有关说法正确的是( )
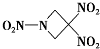
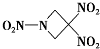
| A、分子中N、O间形成的共价键是非极性键 |
| B、分子中C原子的杂化轨道类型为sp3杂化 |
| C、第一电离能从大到小:O>N>C |
| D、该分子所有原子在同一平面上 |
已知反应:①A2+2B-=2A-+B2②B2+2C-=2B-+C2③C2+2D-=2C-+D2,则A-、B-、C-、D-还原性的正确顺序是( )
| A、A->B->C->D- |
| B、D->C->B->A- |
| C、A->D->B->C- |
| D、D->B->A->C- |