题目内容
部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )


| A、V=224 |
| B、样品中Fe的质量为2.14g |
| C、样品中CuO的质量为3.52g |
| D、未氧化前Fe元素的质量分数约为41.2% |
考点:金属的回收与环境、资源保护
专题:实验设计题
分析:硫酸足量,氧化性:Fe3+>Cu2+>H+,铁离子优先反应,由于滤液A中不含铜离子,且有气体氢气生成,则滤液A中不含铁离子,滤渣3.2g为金属铜,物质的量为0.05mol,即合金样品中总共含有铜元素0.05mol,利用极限法判断样品中CuO的质量问题;
滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,硫酸含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,计算合金中氧元素的质量,进而计算合金中氧原子的物质的量,计算氧原子结合氢离子物质的量,再根据H原子守恒生成氢气的体积,根据质量分数定义计算Fe元素质量分数.
滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,物质的量为0.02mol,铁元素的物质的量为0.04mol,滤液A溶质为过量H2SO4和FeSO4,而铁元素物质的量为0.04mol,说明参加反应硫酸物质的量为0.04mol,硫酸含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,计算合金中氧元素的质量,进而计算合金中氧原子的物质的量,计算氧原子结合氢离子物质的量,再根据H原子守恒生成氢气的体积,根据质量分数定义计算Fe元素质量分数.
解答:
解:A.滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3,其物质的量=
=0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4,说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量
=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol-0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,故A错误;
B.固体为三氧化二铁,其物质的量为
=0.02mol,铁元素的量为0.02mol×2=0.04mol,质量为:0.04mol×56g/mol=2.24g,故B错误;
C.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为
=0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,但是不能确定CuO的具体质量,故C错误;
D.合金中Fe元素的质量为:56g/mol×0.04mol=2.24g,Cu的质量为3.2g,则未氧化前Fe元素的质量分数约为
×100%=41.2%,故D正确;
故选D.
| 3.2g |
| 160g/mol |
| 5.76g-3.2g-2.24g |
| 16g/mol |
B.固体为三氧化二铁,其物质的量为
| 3.2g |
| 160g/mol |
C.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为
| 3.2g |
| 64g/mol |
D.合金中Fe元素的质量为:56g/mol×0.04mol=2.24g,Cu的质量为3.2g,则未氧化前Fe元素的质量分数约为
| 2.24g |
| 2.24g+3.2g |
故选D.
点评:本题考查混合物计算,清楚反应过程是解答关键,侧重解题方法与分析解决问题能力的考查,注意利用极限法与原子守恒解答,难度中等.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
下列各反应达到化学平衡后,加压能使化学平衡向逆反应方向移动的是( )
| A、2NO2?N2O4 |
| B、C(s)+CO2?2CO |
| C、N2+3H2?2NH3 |
| D、H2S?H2+S(s) |
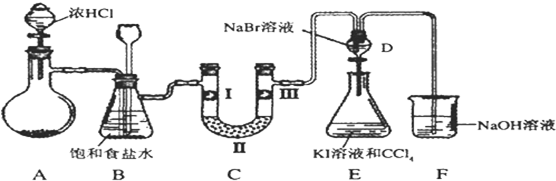
下列对某些离子的检验及结论一定正确的是( )
| A、加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42- |
| B、加入碳酸钠溶液有白色沉淀生成,再加盐酸,沉淀消失,则原溶液中一定有Ba2+ |
| C、通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I- |
| D、加入NaOH溶液并加热,产生使湿润蓝色石蕊试纸变红的气体,则原溶液一定有NH4+ |
下列说法正确的是( )
| A、从海水中获取物质必须经过化学变化 |
| B、工业上以氯气和澄清石灰水为原料制取漂白粉 |
| C、海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” |
| D、氯气泄漏现场应采取喷水雾、喷碱性液体,并杜绝火源、电源等措施 |
下列说法正确的是( )
| A、化学键的断裂和形成是化学反应的实质,化学反应前后能量不变 |
| B、凡是放热反应都是自发的,吸热反应都是非自发的 |
| C、若一个反应的平衡常数越大,则表示该反应速率也越大 |
| D、升高温度化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 |
对于Zn(s)+H2SO4(l)=ZnSO4(l)+H2(g);△H<0(kJ?mol-1)的化学反应,下列叙述一定正确的是( )
A、 反应过程中能量关系可用右图表示 |
| B、1mol锌的能量高于1molH2所含的能量 |
| C、若将该反应设计成原电池,则锌为正极 |
| D、若将其设计为原电池,则当有32.5g锌溶解时,正极放出的气体体积一定为22.4L(标况) |
下列各组物质中,所含分子数相同的是( )
| A、5.6LN2和11gCO2 |
| B、10gH2和10gO2 |
| C、224mLH2(标准状况)和0.1molN2 |
| D、9gH2O和0.5molBr2 |