题目内容
下列说法正确的是( )
| A、强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B、溶液中导电能力的强弱主要与溶液中的离子浓度大小和离子所带电荷数有关 |
| C、强弱电解质的本质区别是溶液导电能力的强弱 |
| D、强电解质的溶液中只有离子,没有分子存在 |
考点:强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:A.溶液导电能力由溶液中离子浓度大小决定,与电解质强弱无关;
B.离子浓度大,阴离子或阳离子所带电荷的绝对值越大,溶液的导电能力越强;
C.强弱电解质的本质区别是电解质能否完全电离;
D.强电解质溶液中只有离子,没有电解质分子,但有水分子;
B.离子浓度大,阴离子或阳离子所带电荷的绝对值越大,溶液的导电能力越强;
C.强弱电解质的本质区别是电解质能否完全电离;
D.强电解质溶液中只有离子,没有电解质分子,但有水分子;
解答:
解:A.溶液导电能力由溶液中离子浓度大小决定,与电解质强弱无关;故A错误;
B.溶液中导电能力的强弱主要与溶液中的离子浓度大小和离子所带电荷数有关,故B正确;
C.强电解质和弱电解质的根本区别是能否完全电离,不是导电能力强弱,故C错误;
D.强电解质溶液中只有离子,没有电解质分子,但有水分子,故D错误;
故选:B.
B.溶液中导电能力的强弱主要与溶液中的离子浓度大小和离子所带电荷数有关,故B正确;
C.强电解质和弱电解质的根本区别是能否完全电离,不是导电能力强弱,故C错误;
D.强电解质溶液中只有离子,没有电解质分子,但有水分子,故D错误;
故选:B.
点评:本题考查了电解质强弱与溶液导电性,明确电解质溶液导电的原因和导电强弱影响因素、明确电解质的强弱本质区别是解题关键,题目难度不大.

练习册系列答案
相关题目
下列有关0.1mol?L-1 NaOH 溶液的叙述正确的是( )
| A、0.1L该溶液中含有NaOH 4.0g |
| B、从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol?L-1 |
| C、100 mL该溶液中含有OH-0.01mol |
| D、在1 L水中溶解4g NaOH即可配制得0.1 mol?L-1NaOH溶液 |
向0.1mol/L的NaOH溶液慢慢滴加同浓度的醋酸溶液,离子浓度之间的关系不可能出现的是( )
| A、c(CH3COO-)>c(H+)>c(Na+ )>c(OH-) |
| B、c(Na+ )>c(OH-)>c(CH3COO-)>c(H+ ) |
| C、c(OH-)>c(Na+ )>c(H+ )>c(CH3COO-) |
| D、c(Na+ )>c(CH3COO-)>c(OH-)>c(H+ ) |
下列叙述正确的是( )
| A、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) |
| B、若用50 mL 0.55 mol?L-1的氢氧化钠溶液,分别与50 mL 0.50 mol?L-1的盐酸和50 mL0.50mol?L-1硫酸充分反应,两反应的中和热不相等 |
| C、0.2 mol/L HCl溶液与等体积0.05 mol/L Ba(OH)2 溶液混合后,溶液的pH=1 |
| D、0.2 mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO32-)+c(OH-) |
在下列各溶液中,一定能大量共存的离子组是( )
| A、常温下pH=7的溶液中:Fe3+、Na+、Cl-、SCN- |
| B、常温下c(OH-)/c(H+)=1014的溶液中:K+、Mg2+、Cl-、Br- |
| C、含有大量HCO3-的澄清透明溶液中:K+、C6H5O-、Cl-、Na+ |
| D、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+ |
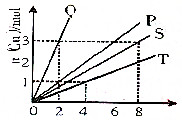 铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应:
铜和硝酸反应的物质的量的关系如图所示,纵坐标表示消耗铜的物质的量,横坐标表示消耗硝酸的物质的量,坐标图中各条线表示下列反应: