题目内容
 常温时向20mL 0.1mol?L-1 HA溶液中不断滴入0.1mol?L-1 NaOH溶液,pH变化如图.下列叙述正确的是( )
常温时向20mL 0.1mol?L-1 HA溶液中不断滴入0.1mol?L-1 NaOH溶液,pH变化如图.下列叙述正确的是( )| A、HA的电离方程式:HA═H++A- |
| B、水的电离程度:a点>b点 |
| C、c点溶液:c(H+)+c(Na+)═c(A-)+c(HA) |
| D、d点溶液:c(Na+)>c(A-)>c(OH-)>c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.c点时,两者恰好完全反应,生成单一的NaA,溶液呈碱性,说明该盐是强碱弱酸盐,HA是弱酸;
B.a点溶液为HA和NaA的混合物,溶液呈酸性,对水的电离起抑制作用;
C.c点时,溶液呈碱性,得到单一的NaA,根据物料守恒;
D.d点为NaOH和NaA的混合物,物质的量之比为1:2,溶液呈碱性.
B.a点溶液为HA和NaA的混合物,溶液呈酸性,对水的电离起抑制作用;
C.c点时,溶液呈碱性,得到单一的NaA,根据物料守恒;
D.d点为NaOH和NaA的混合物,物质的量之比为1:2,溶液呈碱性.
解答:
解:A.c点时,两者恰好完全反应,生成单一的NaA,溶液呈碱性,说明该盐是强碱弱酸盐,HA是弱酸,HA的电离方程式:HA?H++A-,故A错误;
B.a点溶液为HA和NaA的混合物,溶液呈酸性,对水的电离起抑制作用,水的电离程度:a点<b点,故B错误;
C.c点时,溶液呈碱性,得到单一的NaA,根据物料守恒c(Na+)═c(A-)+c(HA),故C错误;
D.d点为NaOH和NaA的混合物,物质的量之比为1:2,溶液呈碱性,故离子浓度大小顺序为:c(Na+)>c(A-)>c(OH-)>c(H+),故D正确;
故选D.
B.a点溶液为HA和NaA的混合物,溶液呈酸性,对水的电离起抑制作用,水的电离程度:a点<b点,故B错误;
C.c点时,溶液呈碱性,得到单一的NaA,根据物料守恒c(Na+)═c(A-)+c(HA),故C错误;
D.d点为NaOH和NaA的混合物,物质的量之比为1:2,溶液呈碱性,故离子浓度大小顺序为:c(Na+)>c(A-)>c(OH-)>c(H+),故D正确;
故选D.
点评:本题考查酸碱混合的判断和离子浓度大小比较,答题时注意a、b、c、d点溶液的组成,把握弱电解质的电离和盐类水解的特点,题目难度中等.

练习册系列答案
相关题目
下列关于稀有气体的叙述正确的是( )
| A、原子的最外电子层都有8个电子 |
| B、化学性质非常不活泼 |
| C、其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 |
| D、原子半径比同周期ⅦA族元素原子的小 |
 图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法正确的是( )
图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图.当电池工作时,下列有关说法正确的是( )| A、电池的能量转化率可达100% |
| B、铝罐是电池的负极 |
| C、碳棒应与玩具电机的负极相连 |
| D、电池工作一段时间后碳棒和炭粒的质量会减轻 |
下列电池中不属于二次电池的是( )
| A、碱性锌锰电池 | B、铅蓄电池 |
| C、镍镉电池 | D、锂离子电池 |
钛被称为21世纪金属.研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图示装置制备金属钛.下列叙述正确的是( )


| A、乙装置阴极的电极反应式为TiO2+4e-═Ti+2O2- |
| B、若不考虑能量的损失,制备24.0g金属钛,需要消耗金属铝36.0g |
| C、甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动 |
| D、乙装置中的石墨电极需要定期更换 |
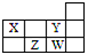 四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )
四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )| A、X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B、Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C、X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D、W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A的原子最外层电子数是次外层电子数的2倍,元素B的原子最外层电子数是其电子层数的3倍,D与A为同主族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A、原子半径:C>D>B>A |
| B、A、D、E最高价氧化物对应水化物酸性增强 |
| C、只含B元素的物质一定是纯净物 |
| D、化合物C2AB3的水溶液显碱性,可用于洗去铜片表面的油污 |
 (1)分子式为C4H10O的醇共有
(1)分子式为C4H10O的醇共有