题目内容
3.短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数的差为8,A原子最外层电子数是其次外层电子数的3倍,B原子在同周期主族元素中的原子半径最大.下列说法正确的是( )| A. | 原子半径:r(C)<r(D)<r(B) | |
| B. | 元素A与B只能形成一种化合物 | |
| C. | A的简单气态氢化物的热稳定性比C的强 | |
| D. | C的最高价氧化物的水化物的酸性比D的强 |
分析 短周期主族元素A、B、C、D的原子序数依次增大,A原子的最外层电子数是其次外层电子数的3倍,由于最外层电子数不超过8,A原子只能有2个电子层,最外层电子数为6,则A为氧元素;A、C的原子序数的差是8,则C为S元素;结合原子序数可知,D为Cl元素;在同周期主族元素中B原子的原子半径最大,处于ⅠA族,原子序数大于O,则B为Na.
解答 解:短周期主族元素A、B、C、D的原子序数依次增大,A原子的最外层电子数是其次外层电子数的3倍,由于最外层电子数不超过8,A原子只能有2个电子层,最外层电子数为6,则A为氧元素;A、C的原子序数的差是8,则C为S元素;结合原子序数可知,D为Cl元素;在同周期主族元素中B原子的原子半径最大,处于ⅠA族,原子序数大于O,则B为Na.
A.同周期自左而右原子半径减小,故原子半径r(Cl)<r(S)<r(Na),即r(D)<r(C)<r(B),故A错误;
B.O与Na元素可以形成氧化钠、过氧化钠,故B错误;
C.O、S同主族,自上而下非金属性减弱,氢化物稳定性减弱,故C正确;
D.S、Cl同周期,自左而右非金属性增强,最高价氧化物对应水化物的酸性增强,故D错误.
故选C.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握,有利于基础知识的巩固.

练习册系列答案
 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
13.A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子序数之和等于B原子的原子序数.B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素的名称:氮、硫、氟.
(2)B位于元素周期表中第三周期ⅥA族.
(3)C的单质与H2反应的化学方程式为:H2+F2=2HF.
(4)写出A的最高价氧化物所对应的水化物与NaOH溶液反应的化学方程式为:NaOH+HNO3=H2O+NaNO3.
| A | C | |
| B |
(2)B位于元素周期表中第三周期ⅥA族.
(3)C的单质与H2反应的化学方程式为:H2+F2=2HF.
(4)写出A的最高价氧化物所对应的水化物与NaOH溶液反应的化学方程式为:NaOH+HNO3=H2O+NaNO3.
11.燃烧质量相同的下列烃,消耗氧气的物质的量最少的是( )
| A. | CH4 | B. | C2H4 | C. | C4H6 | D. | C6H6 |
15.科研、生产、生活中离不开溶液的浓度,相关物质的浓度描述可信的是( )
| A. | 5mol/L 氢硫酸溶液 | B. | 18.4mol/L 盐酸溶液 | ||
| C. | 含甲醛40%的福尔马林溶液 | D. | 含乙酸12%的食醋溶液 |
12.下列说法中正确的是( )
| A. | 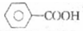 的同分异构体中能发生银镜反应的芳香族化合物有4种 的同分异构体中能发生银镜反应的芳香族化合物有4种 | |
| B. | 纤维素在人体中水解的最终产物是葡萄糖 | |
| C. | 烷烃与聚乙烯结构中均有碳碳单键 | |
| D. | 0.1mol 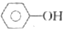 和 和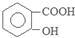 的混合物完全燃烧消耗O215.68L 的混合物完全燃烧消耗O215.68L |
13.设NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A. | 若1mol•L-1HF溶液中H+数目为NA,则等体积的2mol•L-1HF溶液中H+数目为2NA | |
| B. | 44gCO2、N2O组成的混合气体中所含有的原子数为3NA | |
| C. | 36g3H2中含有的中子数目为24NA | |
| D. | 2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA |

 .
.