题目内容
12.下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.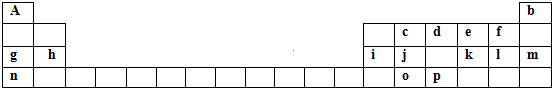
请根据要求用元素符号或化学式回答下列问题:
(1)写出d元素和l元素的名称.d:氮 l:氯
(2)表中所列元素中,原子最外层有2个电子的元素为He、Mg.
(3)画出i元素原子的结构示意图
 ,画出k元素的离子结构示意图
,画出k元素的离子结构示意图
(4)l元素的最高正价是+7,最低负价是-1.
(5)比较元素e、f、g、h的离子半径O2->F->Na+>Mg2+.(写出离子符号)
(6)表中p元素是非金属元素(填“金属”或“非金属”),p元素在元素周期表中的位置是第四周期ⅤA族.
分析 根据元素周期表中元素的位置和分布可以推知a是H,b是He,c是C,d是N,e是O,f是F,g是Na,h是Mg,i是Al,j是Si,k是S,l是Cl,m是Ar,n是K,o是Ge,p为As元素.
(1)由以上分析可知d为氮元素,l为氯元素;
(2)根据核外电子排布判断;
(3)根据核外电子排布特点书写结构示意图;
(4)l是Cl,最外层有7个电子,最高正价为+7价,最低负价为-1价;
(5)e是O,f是F,g是Na,h是Mg,对应离子具有相同的核外电子排布,核电荷数越大离子半径越小;
(6)p为As元素,为非金属元素,位于周期表第四周期ⅤA族.
解答 解:根据元素周期表中元素的位置和分布可以推知a是H,b是He,c是C,d是N,e是O,f是F,g是Na,h是Mg,i是Al,j是Si,k是S,l是Cl,m是Ar,n是K,o是Ge,p为As元素.
(1)由以上分析可知d为氮元素,l为氯元素,故答案为:氮;氯;
(2)表中所列元素中,原子最外层有2个电子的元素为He、Mg,故答案为:He、Mg;
(3)i是Al,原子核外有3个电子层,最外层电子数为3,原子结构示意图为 ,k为S元素,离子核外有3个电子层,最外层电子数为8,离子结构示意图为
,k为S元素,离子核外有3个电子层,最外层电子数为8,离子结构示意图为 ,
,
故答案为: ;
; ;
;
(4)l是Cl,最外层有7个电子,最高正价为+7价,最低负价为-1价,故答案为:+7;-1;
(5)e是O,f是F,g是Na,h是Mg,对应离子具有相同的核外电子排布,核电荷数越大离子半径越小,应为O2->F->Na+>Mg2+,
故答案为:O2->F->Na+>Mg2+;
(6)p为As元素,为非金属元素,位于周期表第四周期ⅤA族,故答案为:非金属;第四周期ⅤA族.
点评 本题考查了周期表的结构应用,原子结构的分析判断,元素性质的应用,为高考常见题型,侧重于学生的分析能力的考查,注意周期表中,元素的推断,规律的应用是解题关键,题目难度中等.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案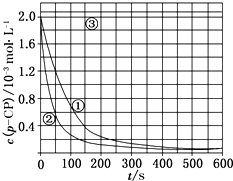 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响.[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验.
(1)请完成以下实验设计表中横线上的内容.
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol•L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | 313 | |||
| ③ | 探究溶液的pH对降解反应速率的影响 | 298 | 10 | 6.0 | 0.30 |
(2)根据如图实验①曲线,计算降解反应50~150s内的反应速率:v(p-CP)=8.0×10-6mol•L-1•s-1. (3)实验①、②表明温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:H2O2在温度过高时迅速分解.
(4)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法:在溶液中加入碱溶液,使溶液的pH大于或等于10.
| A. | 10% | B. | 20% | C. | 50% | D. | 80% |
| A. | $\frac{1}{49}$ | B. | 49 | C. | $\frac{1}{7}$ | D. | 7 |
| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
| A. | 在电流的作用下,氖原子与构成灯管的物质发生反应 | |
| B. | 电子由激发态向基态跃迁时以光的形式释放能量 | |
| C. | 氖原子获得电子后转变成发出红光的物质 | |
| D. | 电子由基态向激发态跃迁时吸收除红光以外的光线 |
| D | ||
| A | B | C |
| E |
(2)上述五种元素的最高价氧化物对应的水化物酸性最强的是(写酸的化学式)H2SO4
(3)上述五种元素的氢化物稳定性最强的是(写氢化物的化学式)H2O,用电子式表示该物质的形成过程
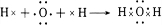 .
.