题目内容
2.将物质的编号填写到与其有关的性质或用途的空格中①浓H2SO4 ②SO2 ③NO2 ④NH3 ⑤HClO ⑥75%的酒精
(1)形成酸雨,污染环境的是②③
(2)液态时做制冷剂的是④
(3)形成光化学烟雾的是③
(4)医疗上用杀菌消毒的是⑥.
分析 形成酸雨的主要气体是二氧化硫、二氧化氮;
氨气沸点高,易液化,液化时能够吸收大量的热;
二氧化氮等氮的氧化物的排放能够引起光化学烟雾;
酒精能够使蛋白质变性,75%的酒精可用作医用酒精.
解答 解:(1)二氧化硫、二氧化氮大量排放是引起酸雨的注意原因,故选:②③;
(2)氨气沸点高,易液化,液化时能够吸收大量的热,故选④;
(3)形成光化学烟雾的是氮的氧化物,故选③;
(4)75%的酒精可用作医用酒精,故选⑥;
故答案为:②③;④;③;⑥.
点评 本题考查了生活中常见的环境污染与治理,熟悉酸雨、光化学烟雾的形成原因,明确医用酒精的浓度是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列说法正确的是( )
| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) | |
| B. | 同浓度的下列溶液中,①NH4HSO4 ②NH4Cl ③NH3•H2O c(NH4+)由大到小的顺序是:②>①>③ | |
| C. | 0.2 mol/L CH3COOH溶液和0.2 mol/L CH3COONa溶液等体积混合(忽略混合时体积变化):c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| D. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
10.下列说法正确的是( )
| A. | 如果某化合物只含共价键,则其一定是共价化合物 | |
| B. | H2O2是由极性共价键和非极性共价键构成的非极性分子 | |
| C. | 两种酸溶液充分反应后的体系不可能为中性 | |
| D. | 碳、氮形成的氢化物常温下都是气态 |
17.X、Y、Z、W为四种短周期主族元素.其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X是地壳中含量最多的元素;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )
| A. | X与W可以形成W2X、W2X2两种化合物 | |
| B. | Y元素最高价氧化物对应水化物的化学式为H2YO4 | |
| C. | X、Y、Z对应氢化物的热稳定性和还原性强弱顺序一致 | |
| D. | Y、Z两元素的简单离子的半径Y>Z |
7.下列实验能达到目的是( )
| 实验目的 | 实验步骤 | |
| A | 检验久置的Na2SO3粉末是否变质 | 取样配成溶液,加入盐酸酸化,再加BaCl2溶液,观察是否生成沉淀 |
| B | 检验碘盐中是否含有碘元素 | 取样配成溶液,加入淀粉溶液,观察溶液是否变蓝 |
| C | 检验碳单质与浓硫酸反应的产物 | 将反应生成的气体通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
| D | 探究铁与水在高温下发生反应 | 将水蒸气通过灼热的铁粉看粉末是否变红 |
| A. | A | B. | B | C. | C | D. | D |
11.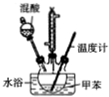 2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
实验中可能用到的数据:
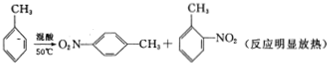
实验步骤:①按体积比3:1配制浓硫酸与浓硝酸混合物40mL;
②在三颈瓶中加入20.0mL甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出2-硝基甲苯和4-硝基甲苯并称重,其总总质量为13.7g.
(1)在烧杯中配制该实验所需混酸的方法是分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌.
(2)步骤④的关键是控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度
分离产物的方案如下:
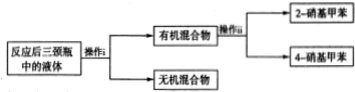
回答下列问题:
操作ii中会用到下列仪器中的ac(填序号).
a.温度计b.蒸发皿c.锥形瓶d.分液漏斗
该实验中2-硝基甲苯和4-硝基甲苯的总产率为53.2%.
(4)实验中的无机混合物可以回收再利用,回收前需要测定各成分的浓度,取10.00mL无机混合物,加水稀释至100.00mL待用,取稀释液10.00mL,用0.1000mol•L-1NaOH溶液滴定至溶液呈中性,消化NaOH溶液VmL,另取稀释液10.00mL,加入过量BaCl2溶液,充分反应后过滤并将滤渣洗涤、干燥后称重,质量为Wg.
①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,左手控制活塞向锥形瓶中加稀释液,此时眼睛应该平视10.20mL的刻度线.
②设计简单实验证明滤渣已经洗涤干净:取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净
③原无机混合物中HNO3的浓度为0.1V-$\frac{2000w}{233}$mol•L-1(用含V和W的代数式表示)
 2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质
2-硝基甲苯和4-硝基甲苯均可用于印染行业,实验室利用下列反应和装置制备这两种物质实验中可能用到的数据:

| 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 2-硝基甲苯 | 137 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
| 4-硝基甲苯 | 137 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
②在三颈瓶中加入20.0mL甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出2-硝基甲苯和4-硝基甲苯并称重,其总总质量为13.7g.
(1)在烧杯中配制该实验所需混酸的方法是分别量取10 mL和30 mL的浓硫酸和浓硝酸,将浓硝酸倒入烧杯中,浓硫酸沿着烧杯内壁缓缓注入,并不断搅拌.
(2)步骤④的关键是控制温度,其措施有水浴加热、充分搅拌和控制滴加混酸的速度
分离产物的方案如下:

回答下列问题:
操作ii中会用到下列仪器中的ac(填序号).
a.温度计b.蒸发皿c.锥形瓶d.分液漏斗
该实验中2-硝基甲苯和4-硝基甲苯的总产率为53.2%.
(4)实验中的无机混合物可以回收再利用,回收前需要测定各成分的浓度,取10.00mL无机混合物,加水稀释至100.00mL待用,取稀释液10.00mL,用0.1000mol•L-1NaOH溶液滴定至溶液呈中性,消化NaOH溶液VmL,另取稀释液10.00mL,加入过量BaCl2溶液,充分反应后过滤并将滤渣洗涤、干燥后称重,质量为Wg.
①取10.00mL稀释液的过程中,酸式滴定管的初始液面为0.20mL,左手控制活塞向锥形瓶中加稀释液,此时眼睛应该平视10.20mL的刻度线.
②设计简单实验证明滤渣已经洗涤干净:取适量最后一次洗涤液于试管中,加入硝酸银,若不产生白色沉淀,则证明洗涤干净
③原无机混合物中HNO3的浓度为0.1V-$\frac{2000w}{233}$mol•L-1(用含V和W的代数式表示)
12.化学与科学、技术、社会、环境密切相关,下列说法正确的是( )
| A. | 研制乙醇汽油技术,能够降低机动车尾气中有害气体的排放 | |
| B. | 联合制碱法生产纯碱时,在饱和食盐水中先通入二氧化碳,再通入氨气 | |
| C. | 接触法制备硫酸的过程中,在吸收塔内是用大量的水吸收三氧化硫 | |
| D. | 工业上通过电解熔融氧化铝制备金属铝时,常常加入冰晶石作助熔剂 |
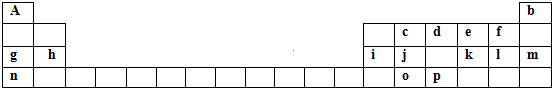
 ,画出k元素的离子结构示意图
,画出k元素的离子结构示意图



