题目内容
将NaOH溶液逐滴加入用盐酸酸化了的AlCl3溶液中,若用y轴表示Al(OH)3沉淀量,x轴表示NaOH溶液的体积,下列图象正确的是( )


| A、A | B、B | C、C | D、D |
考点:离子方程式的有关计算,两性氧化物和两性氢氧化物
专题:
分析:坐标中x轴表示加入NaOH溶液的体积,y轴表示沉淀的量,溶液中含有盐酸,先发生酸碱中和反应,所以氢氧化钠先和盐酸反应生成氯化钠和水,然后氢氧化钠再和氯化铝反应生成氢氧化铝沉淀,当氢氧化钠过量时,氢氧化钠再和氢氧化铝反应生成可溶性的偏铝酸钠,反应方程式为Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,以此来解答.
解答:
解:由信息可知,x轴表示加入NaOH溶液的体积,y轴表示沉淀的量,
则将氢氧化钠溶液逐滴加入含有盐酸的AlCl3溶液中,
先发生NaOH+HCl═NaCl+H2O,所以开始一段时间内没有沉淀生成,故C错误;
酸反应后发生,AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,
所以会出现沉淀,然后随碱的量增加沉淀又消失,故A错误;
且消耗的碱的量之比为3:1,故B错误,D正确;
故选D.
则将氢氧化钠溶液逐滴加入含有盐酸的AlCl3溶液中,
先发生NaOH+HCl═NaCl+H2O,所以开始一段时间内没有沉淀生成,故C错误;
酸反应后发生,AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O,
所以会出现沉淀,然后随碱的量增加沉淀又消失,故A错误;
且消耗的碱的量之比为3:1,故B错误,D正确;
故选D.
点评:本题考查了氢氧化钠和酸性氯化铝溶液的反应现象,明确物质之间的反应及生成物的溶解性是解本题关键,注意离子反应先后顺序,知道铝离子完全转化为沉淀和沉淀完全溶解时两部分氢氧化钠物质的量的关系,难度中等.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、1mol OH-含有的电子数目为9NA | ||
| B、1mol Cl2和氢氧化钠完全反应,转移的电子数目为NA | ||
| C、室温下,1L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1NA | ||
D、1mol
|
室温时,M(OH)2(s)?M2+(aq)+2OH-(aq).Ksp[M(OH)2]=a,c(M2+)=bmol?L-1时,溶液的pH等于( )
A、
| ||||
B、
| ||||
C、14+
| ||||
D、14+
|
下列说法中正确的是( )
| A、放热反应在常温下都能自发进行 |
| B、Fe3++3H2O?Fe(OH)3+3H+是吸热反应 |
| C、熵值大小关系为:S(冰)>S(水)>S(水蒸气) |
| D、对C(s)+H2O(g)?CO(g)+H2(g),多加些炭可以提高化学反应速率 |
下列说法中错误的是( )
| A、根据对角线规则,铍和铝的性质具有相似性 |
| B、[Cu(H2O)4]2+中Cu提供空轨道,H2O中O提供孤对电子形成配位键 |
| C、元素电负性越大的原子,吸引电子的能力越强 |
| D、手性分子互为镜像,它们的性质没有区别 |
下列离子方程式正确的是( )
| A、钠和水的反应:Na+H2O=Na++OH-+H2↑ |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| C、铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
| D、氢氧化钡溶液跟稀硫酸反应:Ba2++OH-+H++SO42-=BaSO↓+H2O |
下列有关化学用语使用正确的是( )
A、氯原子的结构示意图: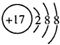 | ||
B、CO2分子的比例模型: | ||
C、具有10个中子的氧原子:
| ||
| D、乙烯的结构简式:C2H4 |
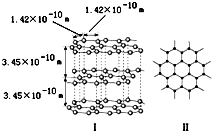 (1)石墨是层状结构,如如图所示.每一层内的碳原子间通过sp2杂化形成
(1)石墨是层状结构,如如图所示.每一层内的碳原子间通过sp2杂化形成