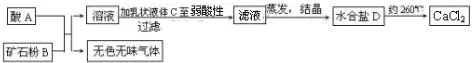
题目内容
1mol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
| A、C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol | ||
B、C(s)+
| ||
| C、C+O2=CO2△H=-393.5 kJ/mol | ||
| D、C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol |
考点:热化学方程式
专题:化学反应中的能量变化
分析:石墨完全燃烧生成CO2,反应放热,△H<0,据此分析.
解答:
解:A.碳的燃烧是放热反应,反应热△H应小于0,为负值,故A错误;
B.石墨完全燃烧生成CO2,故B错误;
C.没有标出物质的聚集状态,故C错误;
D.石墨完全燃烧生成CO2,反应放热,△H<0,热化学方程式为C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol,故D正确.
故选D.
B.石墨完全燃烧生成CO2,故B错误;
C.没有标出物质的聚集状态,故C错误;
D.石墨完全燃烧生成CO2,反应放热,△H<0,热化学方程式为C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol,故D正确.
故选D.
点评:本题考查热化学方程式,题目难度不大,注意热化学方程式的书写方法.

练习册系列答案
相关题目
已研制出的臭鼬剂主要成分是丁硫醇(C4H9SH),人的口臭是由于分泌出有臭味的甲硫醇(CH3SH),液化气中添加的报警剂是极臭的乙硫醇(C2H5SH).下列说法不正确的是( )
| A、丁硫醇与甲硫醇及乙硫醇互为同系物 |
| B、沸点不同的丁硫醇有四种 |
| C、甲硫醇分子中含有四个共价键 |
| D、丁硫醇在空气中完全燃烧生成三氧化硫、二氧化碳和水 |
用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,下列说法错误的是( )
| A、通甲烷的一极为负极,通氧气的一极为正极 |
| B、放电时通入氧气的一极附近溶液的pH升高 |
| C、放电一段时间后,K+的物质的量不变 |
| D、通甲烷的电极反应式是:CH4+8OH--8e-═CO2+6H2O |
下列有关能量的判断或表示方法正确的是( )
| A、从C(s,石墨)═C(s,金刚石)△H=+1.9 kJ?mol-1,可知石墨比金刚石更稳定 |
| B、等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| C、由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ |
| D、2 g H2完全燃烧生成液态水放出 28 5.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ?mol-1 |
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A、H2O(g)═H2(g)+
| ||
| B、2 H2(g)+O2(g)═2 H2O(l);△H2=-484 kJ?mol-1 | ||
C、H2(g)+
| ||
| D、2 H2(g)+O2(g)═2 H2O(g);△H2=+484 kJ?mol-1 |
铁、钴、镍的原子序数分别为26、27、28,它们的性质相似,被称为铁系元素.已知反应Fe2O3+6HCl=2FeCl3+3H2O,Co2O3+6HCl=2CoCl2+Cl2↑+3H2O,则下列物质的氧化能力由强到弱的顺序是( )
| A、Fe2O3>Co2O3>Cl2 |
| B、Cl2>Fe2O3>Co2O3 |
| C、Cl2>Co2O3>Fe2O3 |
| D、Co2O3>Cl2>Fe2O3 |
阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A、36gH2O和22.4LCO2中Si和O,C和O之间的共价键均是4×6.02×1023 |
| B、0.1 L 3 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 |
| C、常温常压下,4.6 g NO2气体含有0.1×6.02×1023个NO2分子 |
| D、0.1 mol的甲基(-CH3)和羟基(-OH)所含电子数均为0.9×6.02×1023 |
 生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.