题目内容
工业上合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H<0,在其他条件不变的情况下,下列说法正确的是( )
| A、加入催化剂,逆反应速率不变 |
| B、增大反应体系的压强,正反应速率一定增大 |
| C、升高温度,反应速率加快,反应放出的热量减小 |
| D、若在原电池中进行,反应放出的热量不变 |
考点:化学反应速率的影响因素
专题:
分析:A.加入催化剂,正逆反应速率都增大;
B.如浓度不变,则反应速率不变;
C.升高温度,平衡逆向移动;
D.形成原电池,化学能转化为电能.
B.如浓度不变,则反应速率不变;
C.升高温度,平衡逆向移动;
D.形成原电池,化学能转化为电能.
解答:
解:A.加入催化剂,降低反应的活化能,活化分子百分数增加,正逆反应速率都增大,故A错误;
B.如通入惰性气体,则浓度不变,反应速率不变,故B错误;
C.正反应为放热反应,则升高温度,平衡逆向移动,放出的热量减小,故C正确;
D.形成原电池,化学能转化为电能,放出的热量减少,故D错误.
故选C.
B.如通入惰性气体,则浓度不变,反应速率不变,故B错误;
C.正反应为放热反应,则升高温度,平衡逆向移动,放出的热量减小,故C正确;
D.形成原电池,化学能转化为电能,放出的热量减少,故D错误.
故选C.
点评:本题考查反应速率的影响因素,为高频考点,侧重于学生的分析能力和基本理论知识的理解和运用的考查,注意相关基础知识的积累,把握影响反应速率的因素和影响原因,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列与金属腐蚀有关的叙述错误的是( )
| A、生铁的抗腐蚀能力比纯铁弱 |
| B、用锡焊接的铁质器件,焊接处易生锈 |
| C、将钢闸门与直流电源的正极相连可防止其被腐蚀 |
| D、轮船外壳在海水中锈蚀的主要原因是发生吸氧腐蚀 |
下列说法不正确的是( )
| A、大米富含淀粉 |
| B、人体必需的微量元素就是维生素 |
| C、加碘食盐含有碘酸钾 |
| D、人体必需的微量元素不都是金属元素 |
在CH3COOH溶液中存在如下平衡:CH3COOH?H++CH3COO-.加入少量下列固体物质,能使平衡逆向移动的是( )
| A、CH3COONa |
| B、NaCl |
| C、Na2CO3 |
| D、NaOH |
下列说法中正确的是( )
| A、处于最低能量的原子叫做基态原子 |
| B、原子由基态变为激发态要产生发射光谱 |
| C、同一原子中,2p能级比3p能级的轨道数少 |
| D、3d轨道能量小于4s |

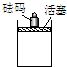 在一定条件下,向如图容器中加入一定量的A和B,发生反应:mA+nB?pC达到平衡.
在一定条件下,向如图容器中加入一定量的A和B,发生反应:mA+nB?pC达到平衡.