题目内容
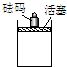 在一定条件下,向如图容器中加入一定量的A和B,发生反应:mA+nB?pC达到平衡.
在一定条件下,向如图容器中加入一定量的A和B,发生反应:mA+nB?pC达到平衡.(1)若A、B、C都是气体,增加砝码,A的转化率增大,则m+n
(2)若m=p,A、C是气体,加入B活塞位置和C的浓度不变,则B为
(3)若A、C是气体,而且m+n=p,减少砝码,平衡发生移动,则平衡是向
(4)设正反应是吸热反应,达平衡时C的质量绝热容器
传热容器.
考点:化学平衡的影响因素
专题:
分析:(1)若A、B、C都是气体,增加砝码即增大压强,A的转化率增大,说明增大压强平衡向正反应方向移动;
(2)若m=p,A、C是气体,加入B活塞位置和C的浓度不变,说明平衡不移动;
(3)若A、C是气体,而且m+n=p,减少砝码即减小压强,平衡向气体体积增大的方向移动;
(4)设正反应是吸热反应,对于绝热容器反应达平衡时温度降低,平衡还要向逆反应方向移动,所以达平衡时C的质量绝热容器<传热容器.
(2)若m=p,A、C是气体,加入B活塞位置和C的浓度不变,说明平衡不移动;
(3)若A、C是气体,而且m+n=p,减少砝码即减小压强,平衡向气体体积增大的方向移动;
(4)设正反应是吸热反应,对于绝热容器反应达平衡时温度降低,平衡还要向逆反应方向移动,所以达平衡时C的质量绝热容器<传热容器.
解答:
解:(1)若A、B、C都是气体,增加砝码即增大压强,A的转化率增大,说明增大压强平衡向正反应方向移动,则m+n>p,故答案为:>;
(2)若m=p,A、C是气体,加入B活塞位置和C的浓度不变,说明平衡不移动,则B为非气态,故答案为:非气;
(3)若A、C是气体,而且m+n=p,减少砝码即减小压强,平衡向气体体积增大的方向移动,即正反应方向移动,故答案为:正;
(4)设正反应是吸热反应,对于绝热容器反应达平衡时温度降低,平衡还要向逆反应方向移动,所以达平衡时C的质量绝热容器<传热容器,故答案为:<;
(2)若m=p,A、C是气体,加入B活塞位置和C的浓度不变,说明平衡不移动,则B为非气态,故答案为:非气;
(3)若A、C是气体,而且m+n=p,减少砝码即减小压强,平衡向气体体积增大的方向移动,即正反应方向移动,故答案为:正;
(4)设正反应是吸热反应,对于绝热容器反应达平衡时温度降低,平衡还要向逆反应方向移动,所以达平衡时C的质量绝热容器<传热容器,故答案为:<;
点评:本题考查外界条件对平衡移动的影响,题目难度不大,注意分析反应的特征为解答该题的关键.

练习册系列答案
相关题目
工业上合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H<0,在其他条件不变的情况下,下列说法正确的是( )
| A、加入催化剂,逆反应速率不变 |
| B、增大反应体系的压强,正反应速率一定增大 |
| C、升高温度,反应速率加快,反应放出的热量减小 |
| D、若在原电池中进行,反应放出的热量不变 |
设NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A、1 mol Na2O2含离子数为4NA |
| B、标准状况下,22.4 L 氯气与足量的氢氧化钠溶液充分反应,转移的电子数为2NA. |
| C、常温常压下,8.0g CH4中含有的氢原子数为2NA |
| D、0.1 mol/L CaCl2溶液中含氯离子数为0.2NA |
在含有Fe3+、Fe2+、Al3+、Cl-的稀溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,溶液中离子数目变化最小的是( )
| A、Al3+、Cl- |
| B、Al3+ |
| C、Fe2+、Cl- |
| D、Fe3+ |
下列说法符合实验事实的有( )
| A、棕红色NO2加压后颜色先变浅后变深 |
| B、向Fe(SCN)3溶液中加入少量KSCN固体,溶液红色变浅 |
| C、把装有NO2气体的烧瓶放入冰水中,气体红棕色变深 |
| D、向新制AgCl悬浊液中滴入Na2S溶液,振荡后沉淀可以由白色变为黑色 |
已知2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol.且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )
| A、920 kJ |
| B、557 kJ |
| C、436 kJ |
| D、188 kJ |
下列说法正确的是( )
| A、40℃时,0.005 mol?L-1 H2SO4溶液的pH为2 |
| B、往氯化铁溶液中滴加氨水来制备氢氧化铁胶体 |
| C、镀锌铁制品镀层受损后,铁制品易生锈 |
| D、已知NaCl溶液和CH3COONH4溶液均显中性,则两溶液中水的电离程度相同 |
关于化学反应与能量的说法正确的是( )
| A、中和反应是吸热反应 |
| B、燃烧属于放热反应 |
| C、化学键形成吸收能量 |
| D、反应物总能量与生成物总能量一定相等 |