题目内容
在酸性溶液中,能大量共存的离子组是( )
| A、K+、OH-、S042- |
| B、Cl-、N03-、Cu2+ |
| C、Al3+、C032-、Na+ |
| D、Ca2+、HC03-、NH4+ |
考点:离子共存问题
专题:离子反应专题
分析:酸性溶液中含大量的H+,离子之间不能结合生成沉淀、气体、水,则离子大量共存,以此来解答.
解答:
解:A.因H+、OH-结合生成水,不能大量共存,故A错误;
C.酸性溶液中该组离子之间不反应,能共存,故B正确;
C.因Al3+、C032-结合生成沉淀和气体,H+、C032-结合生成水和气体,不能共存,故C错误;
D.因H+、HC03-结合生成水和气体,不能大量共存,故D错误;
故选B.
C.酸性溶液中该组离子之间不反应,能共存,故B正确;
C.因Al3+、C032-结合生成沉淀和气体,H+、C032-结合生成水和气体,不能共存,故C错误;
D.因H+、HC03-结合生成水和气体,不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及离子之间的反应即可解答,侧重复分解反应的考查,题目难度不大.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
下列离子方程式正确的是( )
| A、氢氧化镁中滴加盐酸:2H++Mg(OH)2═Mg2++2H2O | ||
| B、金属铝溶于氢氧化钠溶液:2Al+6OH-═2AlO2-+3H2↑ | ||
C、在碳酸氢镁溶液中加入足量Ca(OH)2溶液:Mg2++2HCO
| ||
| D、用FeCl3溶液腐蚀铜电路板:2Fe3++Cu═2Fe2++Cu2+ |
下列叙述中,正确的是( )
| A、金属与酸反应一定放出氢气 |
| B、含金属元素的离子一定是阳离子 |
| C、电离生成H+的化合物不一定是酸 |
| D、金属离子被还原一定得到金属单质 |
100mL 1mol?L-1的氯化铝溶液中加入一定体积的2mol?L-1的NaOH溶液,最终产生3.9g沉淀,则加入的NaOH溶液的体积可能为( )
①45mL ②75mL ③100mL ④175mL.
①45mL ②75mL ③100mL ④175mL.
| A、只有② | B、①③ | C、②④ | D、②③ |
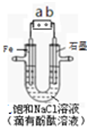 如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是( )| A、a为电源的正极 |
| B、通电一段时间后,石墨电极附近溶液先变红 |
| C、Fe电极的电极反应是4OH--4e-═2H2O+O2↑ |
| D、电解饱和食盐水的总反应是:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ |
 已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为:2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示.则下列有关说法错误的是( )| A、图中AB段主要是高锰酸钾和碘化钾溶液反应 |
| B、图中BC段发生的反应为2Fe3++2I-→2Fe2++I2 |
| C、根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25mol |
| D、根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1mol |
