题目内容
16.某同学在实验室从如图1标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成.从反应物及实验操作猜测:
该黑色物质可能为炭与另一种氧化物组成的混合物.
根据题意和图示回答下面问题:
(1)装置图2中A的名称坩埚.
(2)此氧化物可能是FeO或Fe3O4(写化学式).
(3)对黑色固体物质的组成作如图3所示探究
①实验I加入盐酸溶液的目的是检验黑色固体物质中是否有碳,同时溶解氧化物.
②仅通过实验Ⅱ,用最简步骤能快速确定黑色氧化物的组成,请完善该设计.(限选试剂:稀盐酸、KSCN溶液、10%H2O2溶液)
| 实验操作 | 预期现象与结论 | 相关离子方程式 |
| 取少量实验Ⅰ中的澄清溶液,加入试剂适量的KSCN溶液 | 如果溶液显红色,则黑色物质为Fe3O4,反之则为FeO | Fe3++3SCN-═Fe(SCN)3 |
分析 (1)根据仪器A的构造可知A为坩埚;观察到的淡黄色固体为钠与氧气燃烧产物Na2O2;钠元素焰色反应的火焰颜色为黄色;
(2)根据图1可知,金属钠中含有杂质铁,根据铁的氧化物颜色判断黑色物质的组成可能为氧化亚铁或四氧化三铁;
(3)①黑色固体物质可能为碳和铁的混合物,加入盐酸可以检验是否含有碳,同时将氧化物溶解;
②若含有四氧化三铁,澄清溶液中一定含有铁离子,可以通过检验铁离子进行判断铁色物质组成;若溶液变成红色,说明含有Fe3O4,若没有变成红色,说明黑色固体为FeO,写出铁离子与硫氰根离子反应的离子方程式.
解答 解:(1)根据图示仪器A的构造可知,A仪器为坩埚,故答案为:坩埚;
(2)实验后发现还有少许黑色固体生成,根据图1可知,金属钠中混有杂质铁,铁与氧气反应生成的黑色物质有Fe3O4和FeO,故该氧化物可能是Fe3O4或FeO,
故答案为:FeO;Fe3O4;
(3)①由于黑色固体物质可能为碳和铁的氧化物,碳单质不溶于盐酸,铁的氧化物能够溶液盐酸,所以加入盐酸目的是检验黑色固体物质中是否有碳,同时溶解氧化物,
故答案为:检验黑色固体物质中是否有碳,同时溶解氧化物;
②取少量实验Ⅰ澄清溶液,加入适量的KSCN溶液,如果溶液显红色,则黑色物质为Fe3O4,如果溶液没有变成红色,说明黑色物质为FeO,反应的离子方程式为:Fe3++3SCN-═Fe(SCN)3,
故答案为:
| 适量的KSCN溶液 | 如果溶液显红色,则黑色物质为Fe3O4,反之则为FeO | Fe3++3SCN-═Fe(SCN)3 |
点评 本题考查了金属钠及其化合物的性质、常见化学仪器的构造及名称,题目难度中等,要求学生掌握金属钠及其化合物具有的化学性质,明确检验铁离子和亚铁离子的方法.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案
相关题目
6.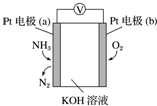 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图.下列说法不正确的是( )| A. | O2在电极b上发生还原反应 | |
| B. | 溶液中OH-向电极a移动 | |
| C. | 反应消耗的NH3与O2的物质的量之比为4:5 | |
| D. | 负极的电极反应式为2NH3-6e-+6OH-═N2+6H2O |
7. 将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
 将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )
将1molH2(g)和2mol I2(g)置于某2L密闭容器中,在一 定温度下发生反应:H2(g)+I2(g)?2HI(g)△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如曲线如图(Ⅱ)所示.若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是( )| A. | 恒温恒容加入适当催化剂 | B. | 恒温条件缩小体积 | ||
| C. | 恒容条件下升高温度 | D. | 恒温条件扩大反应容器 |
5.化学与生活密切相关,下列说法不正确的是( )
| A. | 葡萄糖可用于补钙药物的合成 | |
| B. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| C. | 聚乙烯塑料制品可用于食品的包装 | |
| D. | 生石灰可用作食品抗氧剂 |
 实验室用如图方法测定某水样中O2的含量.
实验室用如图方法测定某水样中O2的含量.
 .
.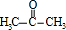 .
. .
.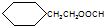
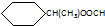 .
.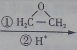 CH3CH2CH2CH2OH(其他试剂任选).
CH3CH2CH2CH2OH(其他试剂任选).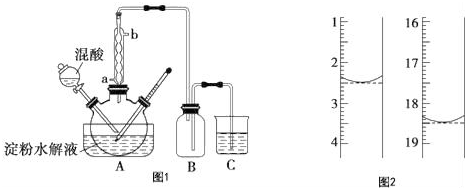

 .
. .
.