题目内容
13.将铁片投入下列溶液中,铁片溶解且可使溶液的质量增加的是( )| A. | Na2SO4溶液 | B. | FeCl3溶液 | C. | Cu(NO3)2溶液 | D. | 稀硫酸 |
分析 根据金属活动性顺序及各物质发生化学反应时的质量比进行分析解答.在金属活动性顺序表中,氢前面的金属能和常见的酸反生反应置,位于前面的金属能把排在它后面的金属从其盐溶液中转换出来.首先确定把铁加入溶液中是否发生反应,如果不反应,则溶液的质量保持不变;如果反应,再看反应后生成的溶质的质量是否增大或减小,从而判断出溶液的质量的变化,
A.铁和硫酸钠溶液不反应;
B.铁和氯化铁反应生成氯化亚铁溶液;
C.铁和硝酸铜发生置换反应生成铜;
D.铁和稀硫酸反应生成硫酸亚铁和氢气.
解答 解:A、在金属活动性顺序表中,铁的位置排在钠的后面,铁与硫酸钠溶液不发生反应,则溶液的质量不变,故A错误;
B、把铁片放入FeCl3溶液中,铁能与氯化铁溶液反应生成氯化亚铁,铁片溶解且溶液的质量会增加,故B正确;
C、铁与硝酸铜反应生产硝酸亚铁和铜,参加反应的铁的质量小于生成的铜的质量,溶液质量减小,故C错误;
D、铁片和硫酸反应生成硫酸亚铁溶液和氢气,进入溶液中发生反应的铁的质量要比逸出的氢气的质量要大得多,溶液的质量会增加,故D正确;
故选BD.
点评 本题难度不是很大,掌握金属的活动性顺序表及其应用并能结合质量守恒定律判断溶液质量的变化情况是正确解答本题的关键.

练习册系列答案
相关题目
5.化学与生活密切相关,下列说法不正确的是( )
| A. | 葡萄糖可用于补钙药物的合成 | |
| B. | 次氯酸钠溶液可用于环境的消毒杀菌 | |
| C. | 聚乙烯塑料制品可用于食品的包装 | |
| D. | 生石灰可用作食品抗氧剂 |
3.铁和足量稀H2SO4反应时,若铁失去0.2mol电子,则参加的铁的质量为( )
| A. | 2.8g | B. | 5.6g | C. | 8.4g | D. | 11.2g |
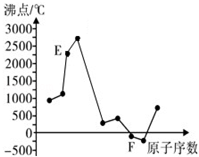 A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大.A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续).
A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大.A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续).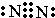 ,化合物AC2的结构式O=C=O;C、D、F对应的简单离子半径由小到大的顺序为Na+<O2-<Cl-(用离子符号表示).
,化合物AC2的结构式O=C=O;C、D、F对应的简单离子半径由小到大的顺序为Na+<O2-<Cl-(用离子符号表示).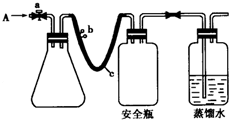 实验室用如图方法测定某水样中O2的含量.
实验室用如图方法测定某水样中O2的含量.
 .
. ,C的最高价氧化物水化物的电子式
,C的最高价氧化物水化物的电子式 ,淡黄色的固体E的电子式
,淡黄色的固体E的电子式 .
.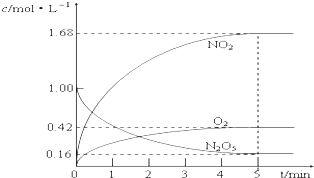 (1)该反应的化学方程式为2N2O5?4NO2+O2
(1)该反应的化学方程式为2N2O5?4NO2+O2