题目内容
下列叙述中正确的是( )
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
考点:电解原理,焓变和熵变,弱电解质在水溶液中的电离平衡
专题:化学反应中的能量变化,电离平衡与溶液的pH专题,电化学专题
分析:A、电解法精炼铜时,以粗铜作阳极,纯铜作阴极;
B、向沸水中滴加FeCl3饱和溶液可以制备Fe(OH)3胶体;
C、将氨水稀释,碱性减弱,但是氢离子浓度增大;
D、根据反应自发进行的判据来进行解答.
B、向沸水中滴加FeCl3饱和溶液可以制备Fe(OH)3胶体;
C、将氨水稀释,碱性减弱,但是氢离子浓度增大;
D、根据反应自发进行的判据来进行解答.
解答:
解:A、电解法精炼铜时,以粗铜作阳极,纯铜作阴极,故A错误;
B、向沸水中滴加FeCl3饱和溶液,利用铁离子的水解原理可以制备Fe(OH)3胶体,故B正确;
C、将氨水稀释,碱性减弱,氢氧根离子浓度减小,但是氢离子浓度增大,故C错误;
D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则△H-T△S<0,反应的△S<0,则该反应的△H<0,故D错误.
故选B.
B、向沸水中滴加FeCl3饱和溶液,利用铁离子的水解原理可以制备Fe(OH)3胶体,故B正确;
C、将氨水稀释,碱性减弱,氢氧根离子浓度减小,但是氢离子浓度增大,故C错误;
D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则△H-T△S<0,反应的△S<0,则该反应的△H<0,故D错误.
故选B.
点评:本题涉及电解原理的应用、反应的自发性判据的应用以及弱电解质的电离知识,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中正确的是( )
| A、标准状况下,1 mol水的体积约为22.4 L |
| B、含有2 mol氧原子的氧单质在标准状况下占有的体积一定是22.4 L |
| C、1 mol气体只有在标准状况下的体积才是22.4 L |
| D、标准状况下,2 L二氧化碳和3 L一氧化碳所含有的原子数目相等 |
20g由两种金属粉末组成的混合物,与足量的盐酸充分反应后得到11.2L氢气(标准状况),这种金属混合物的组成可能是( )
| A、Mg和Al |
| B、Al和Fe |
| C、Fe和Zn |
| D、Zn和Cu |
“善待地球,科学发展,构建和谐”是“世界地球日”的主题.你认为下列行为不符的( )
| A、控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 |
| B、研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 |
| C、开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料 |
| D、实现资源的“3R”利用,即:减少资源消耗、增加资源的重复使用、资源的循环利用 |
用U形管做电解槽,惰性电极电解Na2CO3溶液,阳极和阴极所收集气体的体积比为(气体经干燥,并在同温同压下测量)( )
| A、1:2 | B、2:1 |
| C、略大于1:2 | D、略大于2:1 |
高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸性条件下不稳定),总反应式为Fe+2H2O+2OH-
3H2↑+FeO42-.下列说法正确的是( )
| ||
| A、铁为阳极,H2SO4为电解液 |
| B、阴极发生的电极反应为6H2O+6e-═3H2↑+6OH- |
| C、阳极附近溶液pH变大 |
| D、铁失去3mol电子可以在阴极得到33.6L氢气 |
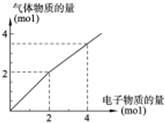 用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为
用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为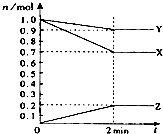 (1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为:
(1)某温度时,在2L容器中,X、Y、Z三种物质的物质的量随时间变化曲线如图所示.由图中数据分析,该反应的化学方程式为: