题目内容
20g由两种金属粉末组成的混合物,与足量的盐酸充分反应后得到11.2L氢气(标准状况),这种金属混合物的组成可能是( )
| A、Mg和Al |
| B、Al和Fe |
| C、Fe和Zn |
| D、Zn和Cu |
考点:有关混合物反应的计算
专题:计算题
分析:假设金属均为+2价,金属总物质的量等于氢气物质的量,计算金属平均摩尔质量,因为为两种金属的混合物,故平均摩尔质量应介于各组分之间,根据电子转移守恒,若金属不与盐酸反应,其摩尔质量可以视作无穷大.
解答:
解:11.2L氢气物质的量为
=0.5mol,假设金属均为+2价,金属总物质的量等于氢气物质的量,故金属平均摩尔质量为
=40g/mol,因为为两种金属的混合物,故平均摩尔质量应介于各组分之间,
A.Mg的摩尔质量为24g/mol,Al为+2价,摩尔质量为27g/mol×
=18g/mol,均小于40g/mol,不符合题意,故A错误;
B.Al为+2价,摩尔质量为27g/mol×
=18g/mol,Fe的摩尔质量为56g/mol,符合题意,故B正确;
C.Fe的摩尔质量为56g/mol,Zn的摩尔质量为65g/mol,均大于40g/mol,不符合题意,故C错误;
D.Zn的摩尔质量为65g/mol,Cu不与盐酸反应,其摩尔质量可以视作无穷大,均大于40g/mol,不符合题意,故D错误,
故选B.
| 11.2L |
| 22.4L/mol |
| 20g |
| 0.5mol |
A.Mg的摩尔质量为24g/mol,Al为+2价,摩尔质量为27g/mol×
| 2 |
| 3 |
B.Al为+2价,摩尔质量为27g/mol×
| 2 |
| 3 |
C.Fe的摩尔质量为56g/mol,Zn的摩尔质量为65g/mol,均大于40g/mol,不符合题意,故C错误;
D.Zn的摩尔质量为65g/mol,Cu不与盐酸反应,其摩尔质量可以视作无穷大,均大于40g/mol,不符合题意,故D错误,
故选B.
点评:本题考查混合物计算、元素化合物性质,难度中等,注意利用平均值法解答.

练习册系列答案
相关题目
短周期元素W、X、Y的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质.根据以上叙述,下列说法中一定正确的是( )
| A、上述四种元素的原子半径大小为Y<X<W |
| B、W、X、Y原子的核外最外层电子数的总和为10 |
| C、由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
| D、W与Y可形成既含极性共价键又含非极性共价键的化合物 |
将 N2、H2混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后反应速率为:甲 v(H2)=3mol/(L?min);乙 v( N2 )=2mol/(L?min);丙 v(NH3)=1mol/(L?min).在这段时间内三个容器中合成氨的反应速率( )
| A、甲>乙>丙 |
| B、甲=乙=丙 |
| C、乙>甲>丙 |
| D、甲>丙>乙 |
将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100mL,则NaOH溶液的浓度为( )
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.8 mol?L-1 |
下列叙述中正确的是( )
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |

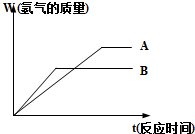 等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示: