题目内容
在体积为1L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
回答下列问题:
(1)该反应的平衡常数表达式K= ,升高温度,化学平衡向 (填“正反应”或“逆反应”)方向移动.
(2)能判断该反应达到化学平衡状态的依据是 .
A.c(CO2)=c(CO)
B.K不变
C.容器中的压强不变
D.v正(H2)=v正(CO2)
E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:[CO2]?[H2]=[CO]?[H2O],此时的温度为 ;在此温度下,若向该容器中投入1mol CO2、1.2mol H2、0.75mol CO、1.5mol H2O,则此时反应朝 方向进行(填“正反应”、“逆反应”).
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的平衡常数表达式K=
(2)能判断该反应达到化学平衡状态的依据是
A.c(CO2)=c(CO)
B.K不变
C.容器中的压强不变
D.v正(H2)=v正(CO2)
E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:[CO2]?[H2]=[CO]?[H2O],此时的温度为
考点:化学平衡建立的过程,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)依据化学方程式和平衡常数概念书写平衡常数表达式;依据平衡常数随温度升温增大,说明平衡正向移动;
(2)依据判断平衡状态的方法来判断即正逆反应速率相同,各组分含量保持不变;
(3)依据平衡常数计算式和图表数据分析判断;
(2)依据判断平衡状态的方法来判断即正逆反应速率相同,各组分含量保持不变;
(3)依据平衡常数计算式和图表数据分析判断;
解答:
(1)由CO2(g)+H2(g)?CO(g)+H2O(g),反应的平衡常数K=
;依据表格数据说明平衡常数随温度升温增大,说明平衡正向移动;
故答案为:
;正反应
(2)A.c(CO2)=c(CO)和起始量和消耗量有关,不能说明反应达到平衡状态,故A错误;
B.平衡常数仅与温度有关,温度一定K就不变,所以K不变不能说明达到平衡状态,故B错误;
C.反应前后气体体积不变,反应过程中和平衡状态压强都不变,容器中压强不变不能说明达到平衡状态,故C错误;
反应速率之比等于化学方程式系数之比,是正反应速率之比,υ正(H2)=υ逆(H2O) 表面水的正逆反应速率相同,反应达到平衡状态,故C正确;
D.v正(H2)=v正(CO2)都是指的正反应方向,不能说明正逆反应速率相同,故D正确;
E.混合气体中 c(H2)不变是平衡标志,故E正确;
故答案为:E;
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),K=1,依据图表数据可知,平衡常数随温度变化,温度不变,平衡常数不变,判断此时的温度为830℃;在此温度下,若向该容器中投入1mol CO2、1.2mol H2、0.75mol CO、1.5mol H2O则有Qc=
=0.9375<1,所以反应向正反应方向进行;
故答案为:830;正反应.
| c(CO)c(H 2O) |
| c(CO 2)c(H 2) |
故答案为:
| c(CO)c(H2O) |
| c(CO2)c(H 2) |
(2)A.c(CO2)=c(CO)和起始量和消耗量有关,不能说明反应达到平衡状态,故A错误;
B.平衡常数仅与温度有关,温度一定K就不变,所以K不变不能说明达到平衡状态,故B错误;
C.反应前后气体体积不变,反应过程中和平衡状态压强都不变,容器中压强不变不能说明达到平衡状态,故C错误;
反应速率之比等于化学方程式系数之比,是正反应速率之比,υ正(H2)=υ逆(H2O) 表面水的正逆反应速率相同,反应达到平衡状态,故C正确;
D.v正(H2)=v正(CO2)都是指的正反应方向,不能说明正逆反应速率相同,故D正确;
E.混合气体中 c(H2)不变是平衡标志,故E正确;
故答案为:E;
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),K=1,依据图表数据可知,平衡常数随温度变化,温度不变,平衡常数不变,判断此时的温度为830℃;在此温度下,若向该容器中投入1mol CO2、1.2mol H2、0.75mol CO、1.5mol H2O则有Qc=
| 0.75×1.5 |
| 1×1.2 |
故答案为:830;正反应.
点评:本题考查化学平衡的影响因素,题目难度中等,解答时首先分析化学方程式的特征,特别是反应前后气体的化学计量数关系以及反应的吸、放热问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述中正确的是( )
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是( )
| A、为防止富脂食品氧化变质,常在包装袋中放入生石灰 |
| B、“天宫一号”中使用的碳纤维,是一种新型无机非金属材料 |
| C、用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
| D、汽车排放的尾气和冬季取暖排放颗粒污染物是形成雾霾的重要因素 |
下列物质的鉴别方法错误的是( )
| A、用酚酞溶液鉴别稀盐酸和稀氢氧化钠溶液 |
| B、用燃着的木条鉴别CO2和O2 |
| C、用稀硫酸鉴别锌片和铜片 |
| D、用加水溶解的方法即可鉴别食盐和白糖 |
下列物质鉴别方法中,正确的是( )
| A、用淀粉溶液鉴别NaBr、KI溶液 |
| B、用KMnO4酸性溶液鉴别CH4、C2H4气体 |
| C、用AgNO3溶液鉴别Na2SO4、NaCl溶液 |
| D、用澄清石灰水鉴别Na2CO3、NaHCO3溶液 |
钓鱼岛及其附属岛屿是中国的固有领土,我国历来十分重视海水资源的综合利用,下列有关海水综合利用的说法不正确的是( )
| A、从海带中提取碘单质的过程不涉及氧化还原反应 |
| B、往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 |
| C、赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 |
| D、虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度很低 |
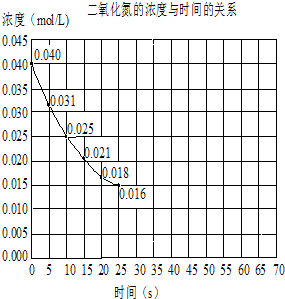 二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L.如图中的曲线表示二氧化氮分解反应在前25s内的反应进程.
二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45s时,达到平衡NO2浓度约为0.0125mol/L.如图中的曲线表示二氧化氮分解反应在前25s内的反应进程.