题目内容
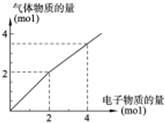 用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为
用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如图所示(不考虑氯气的溶解).若电解结束时,通过电子总物质的量为4mol,电解后恢复至常温,溶液的体积为2L,则混合气体中氢气的物质的量为考点:电解原理
专题:电化学专题
分析:电解氯化钠溶液,阳极上是氯离子失电子,电极反应为:2Cl--2e-═Cl2↑,阴极上是氢离子得电子,电极反应为:2H++2e-═H2↑,通过电子总物质的量为4mol,产生气体的物质的量是4mol,据此计算其中氢气的量.
解答:
解:电解氯化钠溶液,阳极上是氯离子失电子,电极反应为:2Cl--2e-═Cl2↑,阴极上是氢离子得电子,电极反应为:2H++2e-═H2↑,根据图示内容知道,当转移电子总物质的量为4mol,产生气体的物质的量是4mol,所以产生氢气和氯气都是2mol,故答案为:2.
点评:本题考查学生电解池的工作原理以及电极反应式的书写知识,属于基本知识的考查,难度中等.

练习册系列答案
相关题目
将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100mL,则NaOH溶液的浓度为( )
| A、0.1 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.4 mol?L-1 |
| D、0.8 mol?L-1 |
用惰性电极电解一定浓度的CuSO4溶液,一段时间后在电解后的溶液中加入0.1mol Cu(OH)2可以恢复到原来的状态,则电解过程中转移的电子的物质的量为( )
| A、0.1mol |
| B、0.2mol |
| C、0.3mol |
| D、0.4mol |
下列叙述中正确的是( )
| A、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C、常温下,将pH=10的氨水稀释,溶液中所有离子浓度都减小 |
| D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0 |
化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是( )
| A、为防止富脂食品氧化变质,常在包装袋中放入生石灰 |
| B、“天宫一号”中使用的碳纤维,是一种新型无机非金属材料 |
| C、用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
| D、汽车排放的尾气和冬季取暖排放颗粒污染物是形成雾霾的重要因素 |
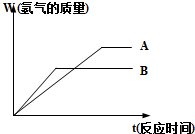 等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示: 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题: