题目内容
2.铝及其化合物在生产生活中具有重要的作用.(1)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明表达式为4Al+3O2=2Al2O3,铝表面能形成致密的氧化膜,能保护内层金属不被氧化.
(2)下列实验能比较镁和铝的金属性强弱的是c(填字母序号).
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1mol/LAlCl3和0.1mol/L MgCl2中加过量NaOH溶液
(3)冶炼金属铝时,用石墨做电极电解熔融Al2O3(填化学式),液态铝在阴(填“阴”或“阳”)极得到.
(4)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2.
NaN3晶体中阴、阳离子个数比为1:1,写出反应化学方程式为AlCl3+3NaN3$\frac{\underline{\;高温\;}}{\;}$3NaCl+4N2↑+AlN.
(5)聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝.实验步骤如下:
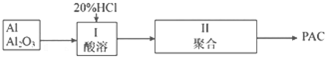
①写出酸溶过程中发生的非氧化还原反应的离子方程式:Al2O3+6H+=2Al3++3H2O
②聚合铝(PAC)的分子式为[Al2(OH)aClb]m,聚合铝中OH-与Al3+的比值对净水效果有很大影响,定义盐基度B=n(OH-):3n(Al 3+ ),当B=$\frac{2}{3}$时,b=2(填入合适数字).
③制取聚合铝的方法有多种,若将步骤I后的溶液pH直接调制4.2-4.5时,将在过程II发生聚合而得到某种聚合铝Alm(OH)nCl3m-n,写出生成该聚合铝的离子反应方程式是nAl3++(3m-n)Cl-+nH2O=Alm(OH)nCl3m-n+nH+.
分析 (1)铝的化学性质比较活泼,而铝在空气中稳定存在,是因表面生成致密的氧化膜;
(2)金属性强弱的判断方法有:置换氢气的难易程度、其最高价氧化物的水化物的碱性强弱、相同类型的盐的pH大小;
(3)工业上用石墨做电极电极熔融氧化铝制备金属铝,铝离子在阴极得到电子生成金属铝;
(4)NaN3晶体中阴离子为N3-、阳离子为Na+,AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2.结合原子守恒配平书写化学方程式;
(5)①酸溶过程中发生的非氧化还原反应是氧化铝与盐酸反应生成氯化铝与水;
②B=n(OH-)/3n(Al3+)=2/3时,则n(OH-)=2n(Al3+),由[Al2(OH)aClb]m可知a=4,再根据化合价代数和为0计算b的值;
③步骤I后的溶液为铝盐溶液,若将步骤I后的溶液pH直接调制4.2-4.5时,将在过程II发生聚合而得到某种聚合铝Alm(OH)nCl3m-n,结合原子守恒书写化学方程式;
解答 解:(1)铝在空气中稳定存在,其原因是在常温下Al与氧气反应,铝表面能形成致密的氧化膜,能保护内层金属不被氧化,反应的化学方程式为:4Al+3O2=2Al2O3,
故答案为:4Al+3O2=2Al2O3,铝表面能形成致密的氧化膜,能保护内层金属不被氧化;
(2)a.金属的导电性强弱不能证明金属的金属性强弱,故a错误;
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH,铝离子和镁离子浓度不同水解程度不同,不能证明金属活泼性,故b错误;
c.氢氧化镁不溶于氢氧化钠,而氢氧化铝能溶于氢氧化钠,说明氢氧化镁的碱性大于氢氧化铝,所以能比较两种金属的金属性强弱,故c正确;
故答案为:c;
(3)冶炼金属铝时,用石墨做电极电解熔融Al2O3,阴极上Al3++3e-=Al,故答案为:Al2O3,阴;
(4)NaN3晶体中阴离子为N3-、阳离子为Na+,晶体中阴、阳离子个数比为1:1,AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN),且生成N2.结合原子守恒配平书写化学方程式为:AlCl3+3NaN3$\frac{\underline{\;高温\;}}{\;}$3NaCl+4N2↑+AlN,
故答案为:1:1;AlCl3+3NaN3$\frac{\underline{\;高温\;}}{\;}$3NaCl+4N2↑+AlN;
(5)①酸溶过程中发生的非氧化还原反应是氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:Al2O3+6H+=2Al3++3H2O;
②B=n(OH-)/3n(Al3+)=2/3时,则n(OH-)=2n(Al3+),由[Al2(OH)aClb]m可知a=4,根据化合价代数和为0有3×2+4×(-1)+b×(-1)=0,解得b=2,故答案为:2;
③步骤I后的溶液为铝盐溶液,若将步骤I后的溶液pH直接调制4.2-4.5时,将在过程II发生聚合而得到某种聚合铝Alm(OH)nCl3m-n,结合原子守恒书写化学方程式为:
nAl3++(3m-n)Cl-+nH2O=Alm(OH)nCl3m-n+nH+,
故答案为:nAl3++(3m-n)Cl-+nH2O=Alm(OH)nCl3m-n+nH+;
点评 本题考查了物质实制备、物质性质、离子方程式书写等知识点,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 加入催化剂,有利于合成氨的反应 | |
| C. | 将混合气体中的氨液化,有利于合成氨的反应 | |
| D. | 工业生产硫酸的过程中,使用过量的空气以提高二氧化硫的转化率 |
NaBr+H2SO4═HBr+NaHSO4 ①
R-OH+HBr?R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下;
| 物质 | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.
a.圆底烧瓶 b量筒. c.锥形瓶 d.容量瓶
(2)溴代烃的水溶性小于(填“大于”、“等于”或“小于”)相应的醇;其原因是醇分子可与水分子形成氢键,溴代烃分子不能与水分子形成氢键.
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,水层在上层(填“上层”、“下层”或“不分层”).
(4)制备操作中,加入的浓硫酸必须进行稀释,其目的不正确的是a.
a.水是反应的催化剂 b.减少Br2的生成
c.减少HBr的挥发 d减少副产物烯和醚的生成
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其原因是平衡向生成溴乙烷的方向移动;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出.
 乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$\stackrel{60℃-80℃}{→}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置.在实验开始时温度计水银球的位置应在试管A的反应液中,目的是控制反应温度为60℃~80℃;当试管A内的主要反应完成后,应进行蒸馏操作,温度计水银球的位置应在在试管A的支管口处.
(3)烧杯B内盛装的液体可以是甘油(写出一种即可).
(4)若想检验试管C中是否含有产物乙酸,在下列所提供的药品或用品中,可以使用的是ab.(填字母)
a.pH试纸 b.碳酸氢钠粉末
c.红色石蕊试纸 d.银氨溶液.
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1 000 s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
| A. | 恒容容器内混合气体的密度不再变化 | |
| B. | AB3的生成速率与B2的生成速率之比为2:3 | |
| C. | 恒压容器内混合气体的总物质的量不再变化 | |
| D. | 单位时间内断裂a mol A≡A键,同时断裂6a mol A-B键 |
| A. | 油脂 | B. | 阿司匹林 | C. | 矿物质 | D. | 维生素 |
