题目内容
14.下列事实不能用勒夏特列原理解释的是( )| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 加入催化剂,有利于合成氨的反应 | |
| C. | 将混合气体中的氨液化,有利于合成氨的反应 | |
| D. | 工业生产硫酸的过程中,使用过量的空气以提高二氧化硫的转化率 |
分析 勒夏特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒夏特列原理解释.
解答 解:A.汽水瓶中存在平衡H2CO3?H2O+CO2,打开汽水瓶时,压强降低,平衡向生成二氧化碳方向移动,可以用勒夏特列原理解释,故A不选;
B.催化剂只改变化学反应速率不影响平衡移动,所以不能用勒夏特列原理解释,故B选;
C.将混合气体中的氨液化,压强减小,平衡向正反应方向移动,有利于合成氨的反应,可以用平衡移动原理解释,故C不选;
D.工业上生产硫酸存在平衡2SO2+O2?2SO3,使用过量的空气,增大氧气的浓度,平衡向正反应移动,可以提高二氧化硫的利用率,能用勒夏特列原理解释,故D不选;
故选B.
点评 本题考查化学平衡移动原理,为高频考点,侧重考查学生对化学平衡移动原理的理解和判断,只有能引起平衡移动的才能用平衡移动原理解释,易错选项是B.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
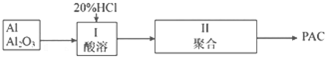
4.铁盐、铝盐可用来净水,近年来科技工作者开发出了一些新的净水剂,如碱式硫酸铁[Fe(OH)SO4]就是一种新型高效净水剂.下图是利用含少量Al2O3、Fe2O3等杂质的废铁屑,生产碱式硫酸铁的工艺流程:
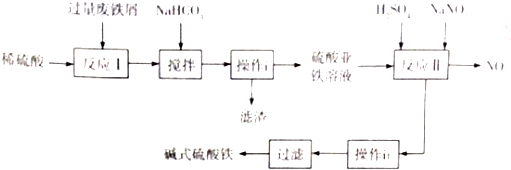
已知:
回答下列问题:
(1)写出反应I中主反应的离子方程式:Fe+2H+═Fe2++H2↑.
(2)加入NaHCO3,调节溶液pH=4.4~5.5,目的是使A13+转化为沉淀除去.
(3)操作i的名称是过滤,滤渣的成分是Al(OH)3、Fe.
(4)反应II的氧化剂与还原剂的物质的最之比为1:1,该反应的还原产物的化学式为NO.
(5)Fe(OH)SO4溶于水后生成Fe(OH)2+,该离子部分水解,生成Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 4.4 |
(1)写出反应I中主反应的离子方程式:Fe+2H+═Fe2++H2↑.
(2)加入NaHCO3,调节溶液pH=4.4~5.5,目的是使A13+转化为沉淀除去.
(3)操作i的名称是过滤,滤渣的成分是Al(OH)3、Fe.
(4)反应II的氧化剂与还原剂的物质的最之比为1:1,该反应的还原产物的化学式为NO.
(5)Fe(OH)SO4溶于水后生成Fe(OH)2+,该离子部分水解,生成Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
5.某固体物质只含有钠和氧两种元素,将它放在足量的水中反应产生两种气体,这两种气体又可以在一定条件下反应牛成水.则原固体物质的组成是( )
| A. | Na2O2与Na2O | B. | Na2O2 | C. | Na2O2与Na | D. | Na和Na2O |
2.在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系,下列有关说法正确的是( )


| A. | c点对应的溶液中大量存在的离子可能为:Na+、H+、Cl-、NO3- | |
| B. | 将25℃时的KCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 | |
| C. | t℃<25℃ | |
| D. | ac线上的任意一点溶液均有c(H+)=c(OH-) |
9.实验室用密度为1.25g•mL-1、质量分数为36.5%的浓盐酸配制240mL 0.1mol•L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为12.5mol.l-1.
(2)配制 240mL 0.1mol•L-1 的盐酸
(1)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次 )BCAFED.
A.用30mL水洗涤烧杯内壁和玻璃棒2〜3次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1〜2cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤,偏低.
②容量瓶中原有少量蒸馏水,不变.
③定容时观察液面俯视,偏高.
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度重新配置.
②向容量瓶中转移溶液时有滚液不慎有溶液溅出重新配置.
③定容摇勻后发现液面下降无需再配.
(1)浓盐酸的物质的量浓度为12.5mol.l-1.
(2)配制 240mL 0.1mol•L-1 的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯内壁和玻璃棒2〜3次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1〜2cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤,偏低.
②容量瓶中原有少量蒸馏水,不变.
③定容时观察液面俯视,偏高.
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度重新配置.
②向容量瓶中转移溶液时有滚液不慎有溶液溅出重新配置.
③定容摇勻后发现液面下降无需再配.
19.2012年8月26日,延安高速公路发生特大交通事故,造成36人死亡,3人受伤.起因是由于客车与装有甲醇的罐车相撞.对危险化学品要在包装标签上印有警示性标志.甲醇应选用的标志是( )
| A. |  | B. |  | C. |  | D. |  |
4.某化学小组欲探究铁及其化合物的氧化性和还原性.请回答下列问题:
(1)请帮助他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液
实验记录:
实验结论:Fe只有还原性;Fe3+只有氧化性;Fe2+既有氧化性,又有还原性.
(2)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时如何防止亚铁盐被氧化加铁粉.
(3)检验某铁盐溶液中是否含有亚铁盐的方法是取少量溶液于试管中滴加1滴酸性KMnO4溶液,若紫色褪去,则有Fe2+.
(1)请帮助他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液
实验记录:
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+=Zn2++Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 变蓝色 | 2Fe3++2I-=2Fe2++I2 | Fe3+具有氧化性 |
(2)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液.那么保存亚铁盐溶液时如何防止亚铁盐被氧化加铁粉.
(3)检验某铁盐溶液中是否含有亚铁盐的方法是取少量溶液于试管中滴加1滴酸性KMnO4溶液,若紫色褪去,则有Fe2+.
 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.
空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物.