题目内容
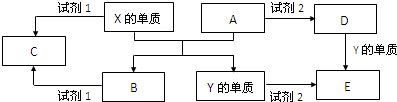
已知A、D、E、G、M、R、X、Y、Z之间存在如图1所示的转化关系(部分产物已略去),其中X、Y、Z为单质,其他为化合物,A具有磁性;E是不溶于水的酸性氧化物,能与氢氟酸反应.
回答下列问题:
(1)组成单质Z的元素在周期表中的位置是 ;化合物G中存在的化学键类型有 ;R的化学式是 .
(2)写出A和D的稀溶液反应生成G的离子方程式: .
(3)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为 .
(4)向含4mol D的稀溶液中,逐渐加入X粉末至过量.假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图(如图2),并标出n(X2+)的最大值.

回答下列问题:
(1)组成单质Z的元素在周期表中的位置是
(2)写出A和D的稀溶液反应生成G的离子方程式:
(3)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为
(4)向含4mol D的稀溶液中,逐渐加入X粉末至过量.假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图(如图2),并标出n(X2+)的最大值.

考点:无机物的推断
专题:推断题
分析:X、Y、Z为单质,其他为化合物.E是不溶于水的酸性氧化物,能与氢氟酸反应,则E为二氧化硅,Y为气体单质,Y与Z反应生成二氧化硅,Y、Z分别为Si、氧气中的一种,其中Y能与NO、水反应得到D,则Y为氧气,D为硝酸,故Z为Si,二氧化硅与氢氧化钠生成M为硅酸钠,硅酸钠与G(硝酸)反应胶体R为H2SiO3.X与Y(氧气)反应得到氧化物A具有磁性,且A能与Al发生反应,可推知X为Fe,A为四氧化三铁,与硝酸反应得到G为硝酸铁,据此解答.
解答:
解:X、Y、Z为单质,其他为化合物.E是不溶于水的酸性氧化物,能与氢氟酸反应,则E为二氧化硅,Y为气体单质,Y与Z反应生成二氧化硅,Y、Z分别为Si、氧气中的一种,其中Y能与NO、水反应得到D,则Y为氧气,D为硝酸,故Z为Si,二氧化硅与氢氧化钠生成M为硅酸钠,硅酸钠与G(硝酸)反应胶体R为H2SiO3.X与Y(氧气)反应得到氧化物A具有磁性,且A能与Al发生反应,可推知X为Fe,A为四氧化三铁,与硝酸反应得到G为硝酸铁,
(1)组成单质Z的元素为Si,处于周期表中第三周期ⅥA族;化合物G为硝酸铁,含有离子键、共价键;R的化学式是:H2SiO3,
故答案为:第三周期ⅥA族;离子键、共价键;H2SiO3;
(2)A和D的稀溶液反应生成G的离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(3)一定条件下,Si与H2反应生成SiH4,分子中Si原子与H原子之间形成1对共用电子对,其电子式为 ,
,
故答案为: ;
;
(4)铁和稀硝酸反应,开始铁全部被硝酸氧化为硝酸铁,故开始阶段Fe2+的量为0,随着铁的加入,多余的铁又和Fe3+反应而生成Fe2+,故Fe2+的量逐渐会增大直至到最大值,以后不变,反应过程中生成的气体为NO,令Fe2+的最大物质的量为xmol,根据电子转移守恒可知,NO的物质的量=
,根据N元素守恒可知:
+2x mol=4 mol,解得x=1.5,故n(Fe2+)随n(Fe)变化的示意图为: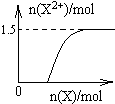 ,
,
故答案为: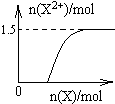 .
.
(1)组成单质Z的元素为Si,处于周期表中第三周期ⅥA族;化合物G为硝酸铁,含有离子键、共价键;R的化学式是:H2SiO3,
故答案为:第三周期ⅥA族;离子键、共价键;H2SiO3;
(2)A和D的稀溶液反应生成G的离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(3)一定条件下,Si与H2反应生成SiH4,分子中Si原子与H原子之间形成1对共用电子对,其电子式为
 ,
,故答案为:
 ;
;(4)铁和稀硝酸反应,开始铁全部被硝酸氧化为硝酸铁,故开始阶段Fe2+的量为0,随着铁的加入,多余的铁又和Fe3+反应而生成Fe2+,故Fe2+的量逐渐会增大直至到最大值,以后不变,反应过程中生成的气体为NO,令Fe2+的最大物质的量为xmol,根据电子转移守恒可知,NO的物质的量=
| xmol×2 |
| 3 |
| xmol×2 |
| 3 |
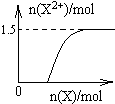 ,
,故答案为:
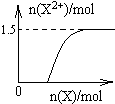 .
.
点评:本题考查无机物推断、常用化学用语、氧化还原反应计算等,难度中等,A与E的性质是推断的突破口,再结合转化关系利用正推法与逆推法相结合推断,(4)注意利用守恒法进行计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列括号中的物质是除去杂质所需的药品,其中不正确的是( )
| A、FeCl2中有CuCl2 (铁粉) |
| B、KCl中有杂质K2SO4(氯化钡) |
| C、N2中混有O2(灼热的铜粉) |
| D、CO2中混有HCl(氢氧化钠溶液) |
20℃时,饱和KCl溶液的密度为1.174g?cm-3,物质的量浓度为4.0mol?L-1,则下列说法中不正确的是( )
| A、20℃时,饱和KCl溶液与等质量的水混合后物质的量浓度大于2.0mol?L-1 |
| B、20℃时,将29.8 gKCl溶于87.6g水中可得饱和溶液 |
| C、20℃时,密度小于1.174g?cm-3的KCl溶液是不饱和溶液 |
| D、将此溶液蒸发部分水,再恢复到20℃时,溶液中各离子的浓度不变 |
把6mol铜粉投入含8mol硝酸和2mol硫酸的稀溶液中,则标准状况下放出的气体的体积为( )
| A、11.2升 |
| B、67.2升 |
| C、4.48升 |
| D、33.6升 |

 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签